
【題目】健康人體內含鐵元素大約2~3g,人體內鐵元素以亞鐵離子和三價鐵離子的形式存在,Fe2+易被吸收,所以給貧血者補充鐵元素時,應補充含Fe2+的亞鐵鹽。“速力菲”(主要成分:琥珀酸亞鐵,呈暗黃色)是市場上一種常見的補鐵藥物。該藥品不溶于水但能溶于人體中的胃酸。某同學為了檢測“速力菲”藥片中Fe2+的存在,設計并進行了如下實驗:

(1)試劑1的名稱是__,試劑2的名稱是__。
(2)加入新制氯水,溶液中發生反應的離子方程式是__。
(3)加入試劑2時溶液為淡紅色說明“速力菲”中的Fe2+已部分氧化,一般在服用“速力菲”時,同時服用維生素C,說明維生素C具有__性。
(4)不僅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,請寫出反應的化學方程式___,現象為__。
【答案】鹽酸 KSCN 2Fe2++Cl2=2Fe3++2Cl- 還原 4Fe(OH)2+O2+2H2O=4Fe(OH)3 白色沉淀迅速變為灰綠色,最終變為紅褐色
【解析】
“速力菲”為補鐵藥物,含Fe2+的亞鐵鹽,不溶于水,可溶于鹽酸;Fe2+溶液呈現淺綠色,具有還原性,Fe3+溶液呈現棕黃色,Fe3+遇硫氰化鉀溶液會呈現血紅色;Fe2+在堿性條件下更容易被氧化,原理為:4Fe(OH)2+O2+2H2O=4Fe(OH)3,表現為先生成白色沉淀,后白色沉淀迅速變為灰綠色,最終變為紅褐色。
(1)加入試劑1的目的為溶解亞鐵鹽,由分析知的亞鐵鹽不溶于水,可溶于鹽酸,所以試劑1為鹽酸,加入鹽酸后溶液呈現淡黃色可知溶液中已有部分Fe2+被氧化成Fe3+,由加入試劑2后溶液呈現紅色可知加入的試劑2為硫氰化鉀溶液,故答案為:鹽酸, KSCN;
(2)氯氣具有氧化性,能將二價鐵離子氧化成三價鐵離子,反應的離子反應方程式為2Fe2++Cl2=2Fe3++2Cl-,故答案為:2Fe2++Cl2=2Fe3++2Cl-;
(3)因為亞鐵離子容易被氧化,所以要一同服用還原性的物質防止亞鐵離子被氧化,即維生素C具有還原性,故答案為:還原;
(4)由分析知白色沉淀Fe(OH)2被O2氧化的化學方程式為4Fe(OH)2+O2+2H2O=4Fe(OH)3,現象為白色沉淀迅速變為灰綠色,最終變為紅褐色,故答案為:4Fe(OH)2+O2+2H2O=4Fe(OH)3,白色沉淀迅速變為灰綠色,最終變為紅褐色。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】在![]() 時,將
時,將![]() 、
、![]() 分別充入兩個各為
分別充入兩個各為![]() 的密閉容器中,反應過程中濃度變化如下:
的密閉容器中,反應過程中濃度變化如下:![]() ,下列說法正確的是
,下列說法正確的是![]()
容器 | 物質 | 起始濃度 | 平衡濃度 |
Ⅰ |
|
|
|
| 0 |
| |
Ⅱ |
| 0 |
|
|
|
|
A.平衡時,Ⅰ、Ⅱ中反應物的轉化率![]()
B.平衡時,Ⅰ、Ⅱ中上述正反應的平衡常數![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]()
C.平衡后,Ⅰ中加入![]() 的
的![]() ,達到新平衡時,反應物的轉化率
,達到新平衡時,反應物的轉化率![]() 增大
增大
D.平衡后,升高溫度,Ⅰ、Ⅱ中氣體顏色都將變深
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有下列物質:
①NH2—CH2—COOH、 ②CH2OH(CHOH)4CHO、③(C6 H10O5 )n (纖維素)、
④ NH2—CH2CH(CH3)—COOH、⑤ HCOOC2H5、⑥![]() 。
。
(1)屬于糖類的是________(填序號,下同),屬于α-氨基酸的是____________;
(2)化合物⑥系統命名為______________,化合物②所含的官能團名稱為__________;
(3)化合物①與⑥混合發生縮合反應可生成的二肽結構(含一個肽鍵)最多有_______種;
(4)寫出化合物①與鹽酸發生反應的化學方程式____________________________________;
(5)能發生水解且水解的最終產物能發生銀鏡反應的是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣凈化反應之一:NO(g)+CO(g)![]()
![]() N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反應在恒容的密閉容器中達到平衡狀態,下列說法正確的是
N2 (g)+CO 2 (g) ΔH=-373.4 kJ·mol-1。若反應在恒容的密閉容器中達到平衡狀態,下列說法正確的是
A. 及時除去二氧化碳,正反應速率加快
B. 混合氣體的密度不變是該平衡狀態的標志之一
C. 降低溫度,反應物的轉化率和平衡常數均增大
D. 其它條件不變,加入催化劑可提高反應物的轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SO2、NO是大氣污染物,NH4NO3、H2SO4等是水體污染物,有效去除這些污染物是一項重要課題。
(1) NO、SO2可以先氧化,后用堿吸收。其氧化過程的反應原理如下:
NO(g)+O3(g)NO2(g)+O2(g);ΔH1=-200.9 kJ·mol-1
SO2(g)+O3(g)SO3(g)+O2(g);ΔH2=-241.6 kJ·mol-1
2SO2(g)+O2(g)2SO3(g);ΔH3=-196.6 kJ·mol-1
則反應2NO2(g)2NO(g)+O2(g)的ΔH= ________kJ·mol-1。
(2) 土壤中的硫循環如圖所示,土壤中的黃鐵礦(FeS2)在過程Ⅰ中會轉化成硫酸亞鐵和硫酸,該過程發生的化學方程式為________;某種反硫化細菌在過程Ⅱ中需要有乳酸參與反應消耗硫酸,生成H2S并伴有熱量放出,那么乳酸除在反應中作還原劑外,還存在另一作用并解釋原因:________。

(3) 電解法除去工業廢水中的硝酸銨的裝置示意圖如圖所示,陰極電極反應式為_______。
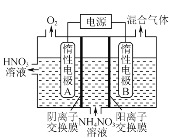
(4) 向恒容密閉容器中充入1 mol NO和2 mol O3,發生如下反應:NO(g)+O3(g)NO2(g)+O2(g);ΔH<0。不同溫度下反應相同時間后,體系中NO轉化率隨溫度變化曲線如圖。溫度低于100 ℃時,NO轉化率隨溫度升高而增大的主要原因是________;當溫度高時,O3分解生成活性極高的氧原子,NO轉化率隨溫度升高而降低,可能的原因有:①________,②________。
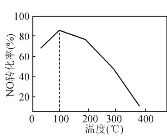
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈷的合金及其配合物用途非常廣泛。
(1) Co3+基態核外電子排布式為________。
(2) 一種Pt、Co金屬間化合物可作為質子交換膜燃料電池的催化劑,其晶胞結構如圖所示,該金屬間化合物的化學式為________。

(3) BNCP可用于激光起爆器等,BNCP可由HClO4、CTCN、NaNT共反應制備。
①ClO4-的空間構型為________ (用文字描述)。
②CTCN的化學式為[Co(NH3)4CO3]NO3,與Co(Ⅲ)形成配位鍵的原子是________ (已知CO32-的結構式為![]() )。
)。
③NaNT可由![]() (雙聚氰胺)為原料制備。雙聚氰胺中碳原子雜化軌道類型為________,1 mol該分子中含σ鍵的數目為________。
(雙聚氰胺)為原料制備。雙聚氰胺中碳原子雜化軌道類型為________,1 mol該分子中含σ鍵的數目為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硝酸是一種重要的化工原料。以![]() 和
和![]() 為原料合成氨氣
為原料合成氨氣![]() 。取一定量的
。取一定量的![]() 和
和![]() 置于密閉容器中進行反應。已知化學平衡常數K與溫度的關系如表:
置于密閉容器中進行反應。已知化學平衡常數K與溫度的關系如表:
| 200 | 300 | 400 |
K |
|
|
|
(1)寫出該反應的平衡常數表達式______。
(2)K1和![]() 比較:
比較:![]() ______
______![]() 填寫“
填寫“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
(3)在![]() 時該反應進行一段時間后,測定
時該反應進行一段時間后,測定![]() 、
、![]() 和
和 ![]() 的物質的量分別為2mol、1mol和2mol,則此時反應速率
的物質的量分別為2mol、1mol和2mol,則此時反應速率![]() ______
______![]() 。
。 ![]() 填寫“
填寫“![]() ”、“
”、“![]() ”、“
”、“![]() ”或“不能確定”
”或“不能確定”![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A.H2、SO2、CO2三種氣體都可用濃H2SO4干燥
B.任何可逆反應,其平衡常數越大,則反應速率、反應物的轉化率就越大
C.在酒精燈加熱條件下,Na2CO3、NaHCO3固體都能發生分解
D.SiO2既能和NaOH溶液反應又能和氫氟酸反應,所以是兩性氧化物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】寫出以下實驗的實驗現象:
(1)向盛有FeCl3溶液的試管中加入KSCN溶液。____
(2)將密封有NO2的玻璃球浸泡在熱水中。________
(3)向酸性高錳酸鉀溶液中加入草酸溶液。______________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com