

| A. | 常壓下五種元素的單質中,Z單質的沸點最高 | |
| B. | Y、Z的陰離子電子層結構都與R原子的相同 | |
| C. | 最高價氧化物對應的水化物的酸性W強于X | |
| D. | Y元素非金屬性比W元素的非金屬性強 |
分析 根據元素在周期表中的位置可知,X為N元素,W為P元素,Y為S元素,R為Ar元素,Z為Br元素,
A.根據物質的在常壓下的存在形式分析,常壓下S、P為固體,而Br為液體;
B.Y的陰離子核外有18個電子,Z的陰離子核外有36個電子,以此進行分析;
C.同一主族中,原子序數越大,非金屬性越強,最高價含氧酸的酸性越強.
D.同周期中,從左到右,元素的非金屬性逐漸增強.
解答 解:根據元素在周期表中的位置可知,X為N元素,W為P元素,Y為S元素,R為Ar元素,Z為Br元素,
A.常壓下S、P為固體,而Br為液體,所以五種元素的單質中Z單質的沸點不是最高的,故A錯誤;
B.Y的陰離子核外有18個電子,與R原子相同,Z的陰離子核外有36個電子,與R得電子層結構不相同,故B錯誤;
C.W、X位于同一主族,非金屬性W<X,非金屬性越強,最高價含氧酸的酸性越強,則最高價氧化物對應的水化物的酸性W小于X,故C錯誤;
D.同周期中,從左到右,元素的非金屬性逐漸增強,即Y元素非金屬性比W元素的非金屬性強,故D正確;
故選D.
點評 本題考查元素周期表位構性的相互關系,題目難度不大,明確原子結構與元素周期表的關系為解答關鍵,注意元素的性質的遞變規(guī)律及其應用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
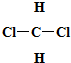 和
和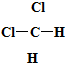 ⑥CH3CH2CH2CH3和
⑥CH3CH2CH2CH3和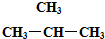
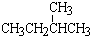 ;
; ③
③ .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第二周期第IA族 | B. | 第三周期第IVA族 | C. | 第二周期第VA族 | D. | 第三周期第VA族 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:F>CI>Br | B. | 最外層電子數都相同 | ||
| C. | 核外電子層數都相同 | D. | 最外層電子數都不相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該原子的摩爾質量是aNA | |
| B. | mg該原子中含有aNA個原子 | |
| C. | mg該原子的物質的量一定是$\frac{m}{a{N}_{A}}$mol | |
| D. | 阿伏加德羅常數NA=$\frac{12}{α}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com