
【題目】Na、Mg、Al、Fe四種金屬中兩種組成的混合物12g,與足量鹽酸反應放出H2 0.5 g(標準狀況),則混合物中必定含有的金屬是
A.鈉B.鎂C.鋁D.鐵
【答案】D
【解析】
假設金屬都是二價金屬,其通式為R,金屬和鹽酸反應方程式為R+2HCl=RCl2+H2↑,n(H2)=![]() =0.25mol,根據方程式知,n(R)=n(H2)=0.25mol,則R的平均摩爾質量=
=0.25mol,根據方程式知,n(R)=n(H2)=0.25mol,則R的平均摩爾質量=![]() =
=![]() =48g/mol,混合物中金屬的摩爾質量應該有大于48g/mol和小于48g/mol的,如果將Na換算為+2價時,其摩爾質量變為46g/mol<48g/mol,鎂的摩爾質量為24g/mol<48g/mol,如果將Al換算為+2價時,其摩爾質量變為18g/mol<48g/mol,Fe的摩爾質量為56g/mol>48g/mol,其中小于48g/mol的有三種,而大于48g/mol只有鐵,所以一定含有Fe,故選D。
=48g/mol,混合物中金屬的摩爾質量應該有大于48g/mol和小于48g/mol的,如果將Na換算為+2價時,其摩爾質量變為46g/mol<48g/mol,鎂的摩爾質量為24g/mol<48g/mol,如果將Al換算為+2價時,其摩爾質量變為18g/mol<48g/mol,Fe的摩爾質量為56g/mol>48g/mol,其中小于48g/mol的有三種,而大于48g/mol只有鐵,所以一定含有Fe,故選D。


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】某化學研究性學習小組為了解從工業溴中提純溴的方法,查閱了有關資料,Br2的沸點為59℃,微溶于水,有毒性和強腐蝕性。他們參觀生產過程后,設計了如下裝置簡圖:
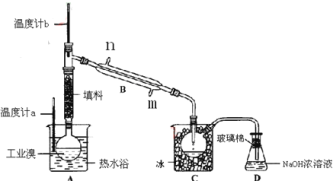
(1)裝置B直形冷凝管進水方向______(填“Ⅱ”或“Ⅲ”),裝置D的名稱是_________。
(2)在A圓底燒瓶中加入一定量工業溴和2小片碎瓷片,加入碎瓷片的作用是_________;如果加熱一段時間后發現忘記加碎瓷片,應該采取的正確操作是_______(填正確答案標號)。A.立即補加 B.冷卻后補加 C.不需補加 D.重新配料
(3)整套實驗裝置中儀器連接均不能用橡膠塞和橡膠管,其原因是_____________________。
(4)實驗裝置氣密性良好,要達到提純溴的目的,操作中如何控制關鍵條件:___________。
(5)裝置C的作用:_____________________。裝置D的作用是________________________。
(6)提純液溴也要用到分液操作,分液漏斗在使用前須清洗干凈并___________;用CCl4提取溴時,產物應該從分液漏斗的______________(填“上口倒出”或“下口放出”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用粗鹽水(溶質主要成分為NaCl),制備NaHCO3固體,流程如圖:
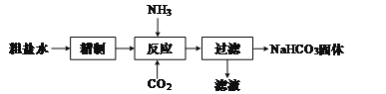
(1)“精制”是為了除去粗鹽水中含有的Ca2+、Mg2+、SO![]() 等雜質離子,并獲得NaCl飽和溶液,“精制”過程中包含除雜、過濾、蒸發濃縮等操作,需要加入的試劑為稍過量的①Na2CO3、②BaCl2、③鹽酸、④NaOH,加入試劑的先后順序為___(填序號)。
等雜質離子,并獲得NaCl飽和溶液,“精制”過程中包含除雜、過濾、蒸發濃縮等操作,需要加入的試劑為稍過量的①Na2CO3、②BaCl2、③鹽酸、④NaOH,加入試劑的先后順序為___(填序號)。
(2)已知“反應”分兩步進行。第一步生成NH4HCO3;
第二步的反應方程式為:NH4HCO3+NaCl=NaHCO3↓+NH4Cl。
①第一步反應的化學方程式為___。
②第二步反應能發生的原因是___。
(3)向“過濾”所得濾液中加入NaCl,并通入氨氣,過濾,得到固體,該固體可能含有NaCl和NH4Cl,檢驗該固體中含有NH4Cl的方法是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是海帶中提取碘的流程圖:
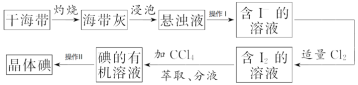
回答下列問題。
(1)干海帶在_____________________中灼燒(填儀器名稱)
(2)操作I名稱為_____________________
(3)分液漏斗在使用前須清洗干凈并_____________________,在本實驗分離過程中,碘的四氯化碳應該從分液漏斗的_____________________(填“上口倒出”或“下口放出”)
(4)操作II名稱為_____________________,該操作中加入碎瓷片的作用是_____________________;如果加熱一段時間后發現忘記加瓷片,應該采取的正確操作是_____________________(填標號)。
A.立即補加B.冷卻后補加C.不需補加D.重新配料
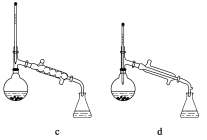
(5)在操作II中,儀器選擇及安裝都最合理的是_____________________(填標號)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某鐵磁粉Fe3O4(可能含有Fe2O3或FeO雜質),為確定其純度,稱取23.28g該樣品利用圖1裝置進行實驗探究。
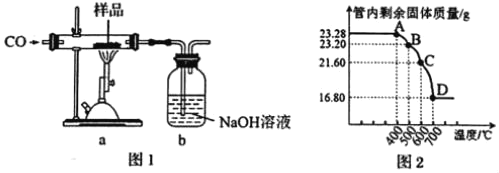
已知:Fe2O3和CO反應是隨溫度升高而逐步進行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe。
請回答:
(1)上述實驗裝置存在一個明顯缺陷是___。
(2)利用儀器測定并繪制出反應過程中a裝置中玻璃管內的固體質量隨溫度的變化曲線(圖2),樣品中含有的雜質成分是___(填化學式)。
(3)上述實驗過程中,CO除作為反應物外,還起到的作用是___。
A.實驗開始時,排盡裝置中的空氣,防止加熱時發生爆炸
B.防止b中的溶液倒吸入a中
C.停止加熱后,繼續通CO氣體,防止生成物被氧化
D.將產生的CO2全部趕入裝置b中,以提高實驗的精確度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】N元素的單質及其化合物之間的轉化關系:NH3N2NO NO2HNO3。回答下列問題:
(1)N元素在元素周期表中的位置為_______;
(2)上述四種氣體只能用排水法收集的是_______(填化學式,下同),只能用排空氣法收集的是______;
(3)氮的氧化物是空氣的主要污染物,下列環境問題與氮的氧化物排放有關的是_____;
A. 酸雨 B. 光化學煙霧 C. 白色污染 D. 臭氧層空洞
(4)NO2形成酸雨的化學方程式為______;
(5)Ertl(獲2007年諾貝爾化學獎)對合成氨機理進行深入研究,并將研究成果用于汽車尾氣處理中,在催化劑存在下可將NO和CO反應轉化為兩種無色無毒氣體,用化學反應方程式表示這個過程______;
(6)若將12.8 g銅與 50 mL一定濃度的濃硝酸反應,兩者恰好完全反應共產生氣體5.6 L(標準狀況),計算此濃硝酸的物質的量濃度_______(寫出解題過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是元素周期表的一部分,請回答下列問題:
IA | IIA | IIIA | IVA | VA | VI A | VII A | 0 族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在這些元素中,單質的化學性質最不活潑的是___________(填元素符號);
(2)③的氣態氫化物的電子式________,②與④形成的氣態化合物的結構式_________;
(3)這些元素形成的最高價氧化物的水化物中,堿性最強化合物的電子式:__________; 酸性最強的含氧酸為__________(填物質的化學式);
(4)②的單質可以和③的最高價氧化物的水化物反應,請寫出有關化學方程式_______;
(5)⑥的單質和⑤的最高價氧化物對應的水化物反應的離子方程式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
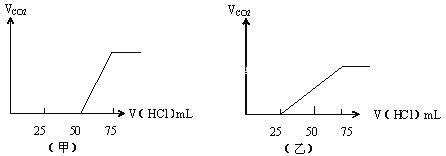
【題目】有50mL NaOH溶液,向其中逐漸通入一定量的CO2,隨后取此溶液10mL將其稀釋到100mL,并向此稀釋后的溶液中逐滴加入0.1mol/L的HCl溶液,產生的CO2氣體體積(標準狀況下)與所加入的HCl的體積之間的關系如圖所示:
試
(1)NaOH在吸收CO2氣體后,在甲、乙兩種情況下,所得溶液中存在的溶質是甲:________,其物質的量之比是:________;乙:__________,其物質的量之比是:__________。
(2)且在兩種情況下產生的CO2氣體(標準狀況)各是甲:________mL;乙:_________mL。
(3)原NaOH溶液的物質的量濃度是_________;若以Na2O2固體溶于水配得100mL溶液需稱量Na2O2_______g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組選用以下裝置進行實驗設計和探究(圖中a、b、c均為止水夾):
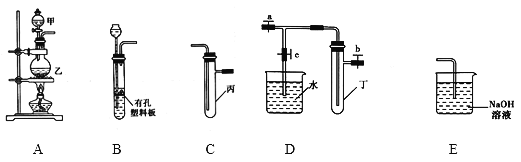
(1)在進行氣體制備時,應先檢驗裝置的氣密性。將A裝置中導管末端密封后,在分液漏斗甲內裝一定量的蒸餾水,然后______,則證明A裝置的氣密性良好。
(2)利用E裝置能吸收的氣體有______(任寫兩種即可)。
(3)用鋅粒和稀硫酸制備H2時應選用裝置___作為發生裝置(填所選裝置的字母序號),實驗時先在稀硫酸中加入少量硫酸銅晶體可使反應速率加快,原因是__。
(4)某同學將A、C、E裝置連接后設計實驗比較Cl-和S2-的還原性強弱。
①A中玻璃儀器甲的名稱為____,A裝置中發生反應的離子方程式為____。
②C中說明Cl-和S2-的還原性強弱的實驗現象_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com