
【題目】目前鈷酸鋰(LiCoO2)鋰離子電池應用十分廣泛,從廢舊鈷酸鋰理離子電池中回收鋁、鐵、鈷、鋰等元素成了重要的研究課題,某小組模擬工業流程從廢舊電池中對上述元素進行提取。
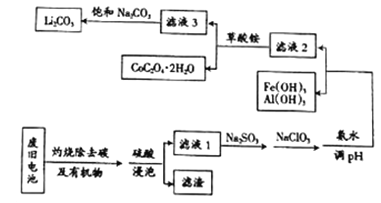
已知:①濾液1中陽離子有H+、CO3+、Fe3+、Al3+、Li+等;
②幾種物質不同溫度下的溶解度如下表所示:
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)鈷酸鋰(LiCoO2)中鈷元素的化合價是_______________。
(2)上述流程中將CoO2-轉化為Co3+的離子方程式為_________________。
(3)濾液1中加入Na2SO3的主要目的是_____________________;加入NaClO3的主要目的是____________。
(4)為了使Fe3+、Al3+沉淀完全(通常認為金屬離子濃度小于或等于10-5mol·L-1時表示已沉淀完全)加入氨水調節pH的最小值是____________(保留一位小數)。{已知:Ksp[Fe(OH)3]=1.0×10-39,Ksp[Al(OH)3]=2.7×10-34,lg3=0.52}
(5)濾液3中加入飽和Na2CO3溶液,過濾后,需要用“熱水洗滌”的原因是_________。
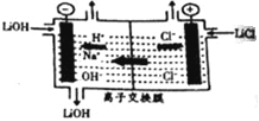
(6)為得到高純度的Li2CO3,需將粗產品Li2CO3與鹽酸反應制得的LiCl進行電解。其原理如圖所示:
①電解時陽極的電解反應式為_____________________。
②電解后向產品LiOH溶液中加入過濾NH4HCO3溶液生成Li2CO3,反應的化學方程式為__________。
【答案】+3 4H++CoO2=== 2H2O+Co3+ 將Co3+氧化為Co2+ 將Fe2+氧化為Fe3+ 4.5 Li2CO3溶解度隨溫度升高而減小,熱水洗滌可減少Li2CO3的損失 2Cl--e-===Cl2↑ 2LiOH+2NH4HCO3===Li2CO3 + (NH4 )2CO3 + 2H2O
【解析】
(1)鈷酸鋰(LiCoO2)中鋰的化合價為+1、氧為-2價,根據化合物化合價代數和為0可知,鈷元素的化合價是+3價;(2)根據流程可知,廢舊電池燃燒除去碳及有機物后利用硫酸浸泡得到的濾液1中陽離子有H+、CO3+、Fe3+、Al3+、Li+等;故將CoO2-轉化為Co3+的離子方程式為4H++CoO2=== 2H2O+Co3+;(3)濾液1中陽離子有H+、CO3+、Fe3+、Al3+、Li+等;亞硫酸鈉具有還原性,能將Co3+氧化為Co2+;NaClO3具有氧化性,能將浸出液中的Fe2+氧化為Fe3+;(4)依據已知的Ksp[Al(OH)3]=2.7×10-34,Ksp[Fe(OH)3]=1.0×10-39,可以求得Al3+和Fe3+完全以氫氧化物沉淀時(即金屬離子濃度小于10-5mol·L-1時)的pH分別為:4.5和3.4;,加入氨水調節pH的最小值是4.5;(5)濾液3中加入飽和Na2CO3溶液,過濾后,需要用“熱水洗滌”的原因是Li2CO3溶解度隨溫度升高而減小,熱水洗滌可減少Li2CO3的損失;(6)①電解LiCl溶液時陽極氯離子失電子產生氯氣,電解反應式為2Cl--e-=Cl2↑;②電解后向產品LiOH溶液中加入過濾NH4HCO3溶液生成Li2CO3,反應的化學方程式為2LiOH+2NH4HCO3===Li2CO3 + (NH4 )2CO3 + 2H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】一定條件下向某密閉容器中加入0.3molA、0.1molC和一定量的B三種氣體,圖1表示各物質濃度隨時間的變化,圖2表示速率隨時間的變化。t2、t3、t4、t5時刻后各改變一種條件,且改變條件均不同。若t4時刻改變條件是壓強,則下列說法錯誤的是
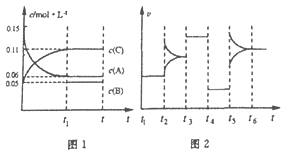
A. 若t1=15s,則前15s的平均反應速率v(C)=0.004mol·L-1·s-1
B. 該反應的化學方程式為:3A(g) ![]() B(g)+2C(g)
B(g)+2C(g)
C. t2、t3、t5時刻改變的條件分別是升高溫度、加入催化劑、增大反應物濃度
D. B的起始物質的量為0.04mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示是一種以液態肼(N2H4)為燃料,氧氣為氧化劑,某固體氧化物為電解質的新型燃料電池。該固體氧化物電解質的工作溫度高達700 -900℃時,O2-可在該固體氧化物電解質中自由移動,反應生成物均為無毒無害的物質。下列說法正確的是

A. 電極甲發生還原反應
B. 電池內的O2-由電極乙移向電極甲
C. 電池總反應為N2H4 +2O2= 2NO +2H2O
D. 當甲電極上有lmol N2H4消耗時,乙電極上有22.4L O2參與反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置不能達到實驗目的的是

A. 裝置Ⅰ:先從①口進氣收集滿CO2,再從②口進氣,可收集NO氣體
B. 裝置Ⅱ:可用該裝置分離葡萄糖和淀粉的混合溶液
C. 裝置Ⅲ:試管中盛有酸性高錳酸鉀溶液可驗證乙烯具有還原性
D. 裝置Ⅳ:證明鐵發生吸氧腐蝕時空氣參加反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】幾種短周期元素的原子半徑及主要化合價如下表: (請用化學用語答題)
元素代號 | X | Y | Z | M | R |
原子半徑/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合價 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1) M在元素周期表中的位置為_____________。
(2)X與Y按原子個數比1∶1構成的物質的電子式為____;所含化學鍵類型______
(3)X+、 Y2-、M2-、R3+離子半徑大小順序為__________。
(4) 寫出Z元素氣態氫化物的形成過程___________。
(5)將YM2通入FeCl3溶液中的離子方程式:______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏加德羅常教的值,N表示粒子數。下列敘述正確的是
A. 在標準狀況下,78g苯的碳碳雙鍵數目為3NA
B. 將1molCl2通入水中,則N(HClO)+N(C1-)+N(C1O-)=2NA
C. 將CO2通過Na2O2使其增重ag時,反應中轉移電子數為aNA/44
D. 200g 30%的甲醛(HCHO)或醋酸溶液中含有的C原子總數都為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2 L密閉容器中氣態物質X和Y反應生成氣態物質Z,它們的物質的量隨時間的變化如下表所示。
(1)根據下表中數據,在下圖中畫出X、Y、Z的物質的量(n)隨時間(t)變化的曲線:_________
t/min | X/mol | Y/mol | Z/mol |
0 | 1.00 | 1.00 | 0.00 |
1 | 0.90 | 0.80 | 0.20 |
3 | 0.75 | 0.50 | 0.50 |
5 | 0.65 | 0.30 | 0.70 |
9 | 0.55 | 0.10 | 0.90 |
10 | 0.55 | 0.10 | 0.90 |
14 | 0.55 | 0.10 | 0.90 |

(2)體系中發生反應的化學方程式是___________________________________________;
(3)列式計算該反應在0~3 min時間內產物Z的平均反應速率:_________________________;
(4)該反應達到平衡時反應物X的轉化率α等于__________________________________________ ;
(5)如果該反應是放熱反應。改變實驗條件(溫度、壓強、催化劑)得到Z隨時間變化的曲線1、2、3(如下圖所示)則曲線1、2、3所對應的實驗條件改變分別是: 1___________________,2_______________________,3______________________。
1___________________,2_______________________,3______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關.下列敘述正確的是( )
A. 采用催化措施,將汽車尾氣中的CO和NO轉化為無害氣體
B. 合金材料中不可能含有非金屬元素
C. 信息產業中的光纜的主要成分是單質硅
D. 14C可用于文物年代的鑒定,14C與12C互為同素異形體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com