
 .
.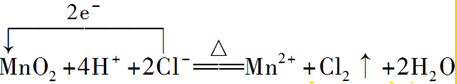 .
.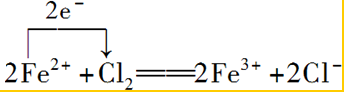 .
. 分析 ①Cu和AgNO3溶液反應生成硝酸銅和金屬銀的反應中,Cu元素的化合價升高,Ag元素的化合價降低,該反應中轉移2e-,以此來解答;
②二氧化錳與濃鹽酸反應生成氯化錳、氯氣和水,反應中Mn元素的化合價降低,轉移2e-,以此來解答;
③向FeCl2溶液中通入Cl2生成FeCl3,鐵元素的化合價升高,該反應中轉移2e-,以此來解答.
解答 解:①Cu和AgNO3溶液反應生成硝酸銅和金屬銀,離子反應為:Cu+2Ag+═Cu2++2Ag,化合價升高值=化合價降低值=轉移電子數=2,電子轉移表示為: ,故答案為:
,故答案為: ;
;
②實驗室制Cl2的反應為MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反應中Mn元素的化合價降低,轉移2e-,則用單線橋標明電子轉移的方向和數目: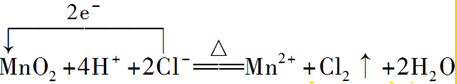 ;
;
故答案為: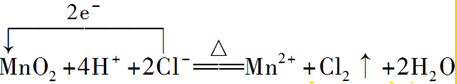 ;
;
③向FeCl2溶液中通入Cl2生成FeCl3,鐵元素的化合價升高,該反應中轉移2e-,則用單線橋標明電子轉移的方向和數目: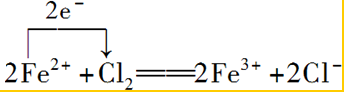 ;
;
故答案為: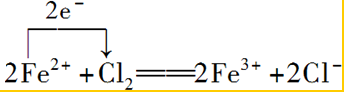 .
.
點評 本題考查學生離子方程式的書寫以及氧化還原反應中的電子轉移知識,屬于基本知識的考查題,難度不大,注意從化合價的角度分析.


 暑假作業暑假快樂練西安出版社系列答案
暑假作業暑假快樂練西安出版社系列答案 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2在Cl2中劇烈燃燒,發出黃色火焰,冒白煙 | |
| B. | SiO2的化學性質不活潑,不與任何酸發生反應 | |
| C. | 常溫下,鋁、鐵遇濃硫酸會發生鈍化反應 | |
| D. | 將氯氣通入紫色石蕊試液中一些時間后,溶液變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
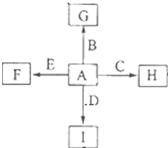 如圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物,已知:
如圖中,A、B、C、D、E是單質,G、H、I、F是B、C、D、E分別和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 金屬離子 | Fe3+ | Cu2+ |
| 氫氧化物開始沉淀時的pH | 1.9 | 4.7 |
| 氫氧化物完全沉淀時的pH | 3.2 | 6.7 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com