
100℃時,在1L恒溫恒容的密閉容器中,通入0.1
mol N2O4,發生反應:N2O4(g)
 2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的濃度如圖甲所示。NO2和N2O4的消耗速率與其濃度的關系如乙圖所示,
2NO2(g);△H= +57.0 kJ·mol-1,NO2和N2O4的濃度如圖甲所示。NO2和N2O4的消耗速率與其濃度的關系如乙圖所示,
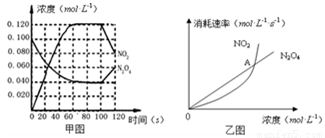
(1)在0~60s內,以N2O4表示的平均反應速率為 mol·L-1·s-1 。
(2)根據甲圖中有關數據,計算100℃時該反應的平衡常數K1= =0.36mol.L-1.S-1
若其他條件不變,升高溫度至120℃,達到新平衡的常數是k2 ,則k1 k2 (填“>”、“<”或“=”)。(3)反應進行到100s時,若有一項條件發生變化,變化的條件可能是 。
A.降低溫度 B.通入氦氣使其壓強增大 C.又往容器中充入N2O4 D.增加容器體積
(4)乙圖中, 交點A表示該反應的所處的狀態為 。
A.平衡狀態 B.朝正反應方向移動 C.朝逆反應方向移動 D.無法判斷
(5)已知N2(g)+2O2(g)=2NO2(g) △H= +67.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534.7 kJ·mol-1
N2O4(g)  2NO2(g)
△H= +57.0 kJ·mol-1
2NO2(g)
△H= +57.0 kJ·mol-1
則2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H= kJ·mol-1
(1)、10-3 (2分); (2)、c2 NO2/ c N2O4(或0.122/0.04)(2分),<(2分)
(3)、A (4分) (4)、B(3分) (5)、-1079.6 (3分,未寫“-”號扣1分)
【解析】
試題分析: (1)由甲圖可知,在60s時,N2O4的濃度為0.04 mol·L-1 ,所以以N2O4表示的平均反應速率為v=(0.1-0.04) mol·L-1÷60s=0.001 mol·L-1·s-1 。
(2)甲圖可知在反應到60s時,反應物和生成物的濃度保持不變,所以此時反應達平衡,平衡常數K1=c2(NO2)/ c(N2O4)=0.122/0.04=0.36mol.L-1.S-1 ;因為該反應的焓變△H>0,所以是個放熱反應,所以升高溫度,平衡正向移動,平衡常數增大,k1<k2 。
(3)從圖像上來看,100s時,反應物濃度增大,生成物濃度減小,說明平衡逆向移動,所以這一改變的條件可能是降低溫度,平衡逆向移動了,A正確;通入不反應的惰性氣體對反應無影響,B錯誤;反應物和生成物的變化量之比為1:2,所以不是改變反應物和生成物的量,C錯誤;增大容器的體積,系統壓強減小,各物質的濃度瞬間改變,且平衡正向移動,所以D錯誤;故選A。
(4)乙圖中交點A表明此刻v(NO2)消耗= v(N2O4)消耗,但v(NO2)生成= 2v(N2O4)消耗,所以v(NO2)生成>v(NO2)消耗,所以反應正向進行,故選B。
(5)根據熱化學方程式和蓋斯定律可知,所求方程式=2×②+③-①,所以△H=2×△H2 +△H3-△H1=-1079.6 kJ·mol-1 。
考點:本題考查的是化學反應速率、化學平衡、化學反應與能量的知識點。


 活力試卷系列答案
活力試卷系列答案 課課優能力培優100分系列答案
課課優能力培優100分系列答案科目:高中化學 來源: 題型:
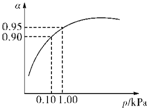 硫酸生產主要有硫磺法和硫鐵礦法等,這兩種制法均經過催化氧化步驟.
硫酸生產主要有硫磺法和硫鐵礦法等,這兩種制法均經過催化氧化步驟.| 容器 | 甲 | 乙 | 丙 |
| 反應物投入量 | 2molSO2、1molO2 | 2molSO3 | mmolSO2、nmolO2、pmolSO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量變化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| SO2或SO3的轉化率 | α1 | α2 | 12.5% |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| ||
| ||
| ||
| 太陽光 |
| ||
| 溫度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常數 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
利用光能和光催化劑,可將CO2和H2O轉化為CH4和O2。紫外光照射時,在不同催化劑(I、II、III)作用下,CH4產量隨光照時間的變化如下左圖所示。


(1)在0-30小時內,CH4的平均生成速率vI、vII和vIII從大到小的順序為 ;反應開始后的12小時內,在第 種催化劑的作用下,收集的CH4最多。
(2)將所得CH4與H2O(g)通入聚焦太陽能反應器,一定溫度下發生反應:CH4(g)+H2O(g)![]() CO(g)+3H2(g) K=27mol2·L-2。將等物質的量的CH4和H2O(g)充入1L恒容密閉容器,在上述溫度下發生反應達到平衡,測得CO的物質的量為0.10mol,CH4的平衡轉化率為 (保留兩位有效數字)。
CO(g)+3H2(g) K=27mol2·L-2。將等物質的量的CH4和H2O(g)充入1L恒容密閉容器,在上述溫度下發生反應達到平衡,測得CO的物質的量為0.10mol,CH4的平衡轉化率為 (保留兩位有效數字)。
(3)甲烷燃料電池是利用CH4跟氧氣或空氣反應將化學能轉化成電能的裝置,電解質溶液是強堿。下面有關說法正確的是 (填編號)。
A.負極反應為:O2+2H2O+4e- -→4OH-;
B.負極反應為:CH4+10OH- - 8e--→CO32-+7H2O
C.放電時溶液中的陰離子向負極移動
D.隨放電的進行,溶液的pH值不變
(4)如上右圖是一個電化學裝置示意圖,甲烷燃料電池作其電源。
①如果A為含有鐵、銀、金、碳雜質的粗銅,B為純銅,C為CuSO4溶液,通電后,Cu2+的濃度將 (填“增大”、“減小”或“不變”)。
②如果A是鉑電極,B是石墨電極,C是KBr溶液,通電時陽極的電極反應式是__________________________。
③特定條件下,該裝置使用惰性電極電解Na2SO4濃溶液可制得少量過氧化氫:在陽極上SO![]() 被氧化成S2O
被氧化成S2O![]() (過二硫酸根離子),S2O
(過二硫酸根離子),S2O![]() 與H2O反應即可生成H2O2,
與H2O反應即可生成H2O2,
S2O![]() +2H2O === 2SO
+2H2O === 2SO![]() +H2O2+2H+。若各反應物質的轉化率均為100%,則要制取1 mol H2O2,理論上燃料電池需消耗CH4的物質的量為 。
+H2O2+2H+。若各反應物質的轉化率均為100%,則要制取1 mol H2O2,理論上燃料電池需消耗CH4的物質的量為 。
查看答案和解析>>
科目:高中化學 來源:模擬題 題型:填空題
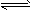 2NO2(g) 的平衡常數為_______,N2O4的轉化率為______。
2NO2(g) 的平衡常數為_______,N2O4的轉化率為______。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com