
 SO2、NOx是重要的空氣污染源,必須經過處理后才能排放.一種工業尾氣含SO2、O2、N2和CO2,某同學采用圖示裝置來測定該尾氣中SO2的含量.
SO2、NOx是重要的空氣污染源,必須經過處理后才能排放.一種工業尾氣含SO2、O2、N2和CO2,某同學采用圖示裝置來測定該尾氣中SO2的含量.| 1 |
| 2 |


科目:高中化學 來源: 題型:閱讀理解
 CO2、SO2、NOx是重要的非金屬氧化物,與我們的生存環境息息相關.
CO2、SO2、NOx是重要的非金屬氧化物,與我們的生存環境息息相關.| C(HCO3-)C(OH-) |
| C(CO32-) |
| C(HCO3-)C(OH-) |
| C(CO32-) |
| 5 |
| 144 |
| 5 |
| 144 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CO2、SO2、NOx是重要的非金屬氧化物,與我們的生存環境息息相關.
CO2、SO2、NOx是重要的非金屬氧化物,與我們的生存環境息息相關.查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
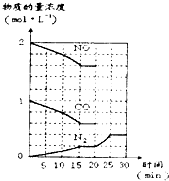
查看答案和解析>>
科目:高中化學 來源:2011年山東省淄博一中高考模擬化學試卷(4月份)(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com