
【題目】![]() 表示阿伏加德羅常數,下列說法正確的是
表示阿伏加德羅常數,下列說法正確的是
A.1mol硝基![]() 與46g二氧化氮
與46g二氧化氮![]() 所含的電子數均為
所含的電子數均為![]()
B.![]() 液與
液與![]() 溶液中的
溶液中的![]() 數目相同
數目相同
C.標準狀況下,![]() 三氯甲烷中含碳氯共價鍵的數目為
三氯甲烷中含碳氯共價鍵的數目為![]()
D.向FeI2溶液中通入適量![]() ,當有
,當有![]() 被氧化時,轉移的電子數為
被氧化時,轉移的電子數為![]()
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】根據下述轉化關系,回答問題:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物質苯環上一鹵代物只有兩種。
(1)寫出B物質的名稱__________;D物質的結構簡式________。
(2)寫出反應②的類型________;反應⑤的條件________。
(3)寫出反應⑥的化學方程式:________________________________。
(4)寫出D+E反應的化學方程式:_______________。
(5)反應②還有可能生成一種C16H18的有機物,其苯環上一鹵代物也只有兩種,寫出它的結構簡式:_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】被稱之為“軟電池”的紙質電池,其電池總反應為Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列說法正確的是( )
ZnO+2MnO(OH)。下列說法正確的是( )
A.該電池的正極為鋅
B.該電池反應中二氧化錳起催化劑作用
C.當65 g Zn完全溶解時,流經電極的電子為1mol
D.電池正極反應式為2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E、F六種短周期元素,原子序數依次增大,A、E同主族,D、F同主族,A元素的原子半徑是所有原子中最小的,B元素原子的最外層電子數是內層電子數的2倍,C元素的最高價氧化物的水化物X與其氫化物反應生成一種鹽Y,A、B、C、E、F五種元素都能與D元素形成原子個數比不相同的常見化合物。回答下列問題:
(1)F元素在周期表中的位置__________,在以上元素最高價氧化物的水化物中,堿性最強的化合物的電子式是:__________。
(2)D、F的氣態氫化物,沸點較高的是___________(填分子式)。
(3)A單質與C單質在一定條件下可化合為Z,常溫下,向pH=a的Z的水溶液中加入等體積pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH______7(填“>”“<”或“=”),原因是_________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應3A(g)+B(g)![]() 2C(g)+2D(g) ΔH<0,圖中,a、b曲線分別表示在不同條件下,A與B反應時,D的體積分數隨時間t的變化情況。若想使曲線b(實線)變為曲線a(虛線),可采用的措施是
2C(g)+2D(g) ΔH<0,圖中,a、b曲線分別表示在不同條件下,A與B反應時,D的體積分數隨時間t的變化情況。若想使曲線b(實線)變為曲線a(虛線),可采用的措施是

①增大A的濃度 ②升高溫度 ③增大D濃度 ④加入催化劑 ⑤恒溫下,縮小反應容器體積 ⑥加入稀有氣體,保持容器內壓強不變
A. ①②③ B. ④⑤ C. ③④⑤ D. ④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH與離子濃度變化的關系如圖所示。下列有關說法正確的是
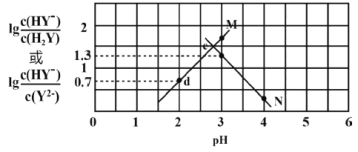
A.曲線N表示pH與![]() 的變化關系
的變化關系
B.交點e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
C.d點溶液中:c(H+)-c(OH-)=c(Y2-)+c(HY-)-c(K+)
D.Ka2(H2Y)=10-4.3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿伏加德羅常數的值為![]() 。下列說法正確的是
。下列說法正確的是
A.![]() 氧氣與
氧氣與![]() 金屬鈉充分反應,轉移的電子數為
金屬鈉充分反應,轉移的電子數為![]()
B.加熱時,![]() 銅粉與足量濃硫酸反應,轉移的電子數為
銅粉與足量濃硫酸反應,轉移的電子數為![]()
C.將![]() 乙烷和
乙烷和![]() 混合光照,生成一氯乙烷的分子數為
混合光照,生成一氯乙烷的分子數為![]()
D.![]() 的
的![]() 溶液中
溶液中![]() 的數目小于
的數目小于![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從鎳礦石尾礦中提取NiSO4是解決我國鎳資源匱乏的一條重要途徑,已知該過程如下:
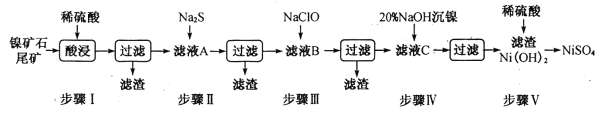
表1:各物質的Ksp數據如下表:
物質 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:濾液A中各金屬離子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
含量/g·L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根據以上信息,回答下列問題:
(1)步驟I酸浸之前需將礦石粉碎,目的是_______________。
(2)
(3)常溫下進行步驟Ⅲ的目的是為了除去鐵和錳元素,已知除鐵元素的離子反應如下:2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl- +4H+,此時Mn2+的氧化產物為MnO2,寫出除錳元素的離子方程式_____________。
(4)所得Ni(OH)2是制造鎳鎘電池的重要原料,鎳鎘電池工作原理如下:Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2,則隨著放電的進行,正極區pH______(填“增大”、“減小”或“不變”);充電時陰極電極反應式為______________________。
Cd(OH)2+2Ni(OH)2,則隨著放電的進行,正極區pH______(填“增大”、“減小”或“不變”);充電時陰極電極反應式為______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,用滴定管量取一定體積的濃氯水置于錐形瓶中,用NaOH溶液以恒定速度來滴定該濃氯水,根據測定結果繪制出ClO-、ClO3-等離子的物質的量濃度c與時間t的關系曲線如下。下列說法正確的是( )

A.NaOH溶液和濃氯水可以使用同種滴定管盛裝
B.a點溶液中存在如下關系:c(Na+) + c(H+) = c(ClO-)+ c(OH-)+ c(ClO3-)
C.b點溶液中各離子濃度:c(Na+) > c(Cl-) > c(ClO-) = c(ClO3-)
D.t2~t4,ClO-的物質的量下降的原因可能是ClO-自身歧化:2ClO-= Cl-+ ClO3-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com