

分析 硫鐵礦燒渣加入硫酸后生成硫酸亞鐵、硫酸鐵,過濾后得到的濾渣為二氧化硅,濾液中加入過量鐵粉,生成硫酸亞鐵溶液,調節pH后加入碳酸氫銨溶液,可生成碳酸亞鐵固體,經洗滌、干燥,在空氣中灼燒時發生分解,且與空氣中的氧氣發生氧化還原反應,可生成氧化鐵,
(1)酸溶過程中四氧化三鐵和酸反應生成亞鐵離子、鐵離子和水;
(2)根據分析可知,步驟Ⅱ為過濾,據此判斷所需儀器,步驟Ⅳ中調節pH值的試劑要能與酸反應且不引入新的雜質;
(3)步驟Ⅲ是將鐵離子還原成亞鐵離子,檢驗步驟Ⅲ已經進行完全,即溶液中沒有鐵離子;
(4)步驟Ⅴ是加入碳酸氫銨產生碳酸亞鐵溶液,溫度過高亞鐵離子水解程度增大同進碳酸氫銨容易分解;
(5)步驟Ⅵ中發生反應為碳酸亞鐵在空氣中與氧氣發生氧化還原反應,可生成氧化鐵;
(6)根據溶液中c(Fe2+)•c(OH-)2與Ksp[Fe(OH)2]比較,可判斷有無Fe(OH)2沉淀;
(7)根據題意,最后稱得殘留固體bg為氧化鐵,則鐵元素的質量為$\frac{112}{160}$×bg=0.7bg,根據鐵元素守恒可知樣品中鐵元素的質量為0.7bg,據此計算;
解答 解:硫鐵礦燒渣加入硫酸后生成硫酸亞鐵、硫酸鐵,過濾后得到的濾渣為二氧化硅,濾液中加入過量鐵粉,生成硫酸亞鐵溶液,調節pH后加入碳酸氫銨溶液,可生成碳酸亞鐵固體,經洗滌、干燥,在空氣中灼燒時發生分解,且與空氣中的氧氣發生氧化還原反應,可生成氧化鐵,
(1)酸溶過程中四氧化三鐵和酸反應生成亞鐵離子、鐵離子和水,“酸溶”過程中Fe3O4發生反應的離子方程式為Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案為:Fe3O4+8H+=Fe2++2Fe3++4H2O;
(2)根據分析可知,步驟Ⅱ為過濾,過濾操作所用的玻璃儀器有漏斗、玻璃棒和燒杯等,步驟Ⅳ中調節pH值的試劑要能與酸反應且不引入新的雜質,所以用氨水較好,故選D,
故答案為:漏斗;D;
(3)步驟Ⅲ是將鐵離子還原成亞鐵離子,檢驗步驟Ⅲ已經進行完全,即溶液中沒有鐵離子,可以用KSCN溶液,
故答案為:KSCN溶液;
(4)步驟Ⅴ是加入碳酸氫銨產生碳酸亞鐵溶液,溫度過高亞鐵離子水解程度增大同進碳酸氫銨容易分解,所以溫度一般需控制在35℃以下,
故答案為:防止NH4HCO3分解,減少Fe2+的水解;
(5)步驟Ⅵ中發生反應為碳酸亞鐵在空氣中與氧氣發生氧化還原反應,可生成氧化鐵,反應方程式為4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2,
故答案為:4FeCO3+O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+4CO2;
(6)由題中數據可知,溶液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=4.9×10-17,故無Fe(OH)2沉淀生成,
故答案為:否;溶液中c(Fe2+)•c(OH-)2=1×10-6×(1×10-5.5)2=1×10-17<Ksp[Fe(OH)2]=4.9×10-17,故無Fe(OH)2沉淀生成;
(7)根據題意,最后稱得殘留固體bg為氧化鐵,則鐵元素的質量為$\frac{112}{160}$×bg=0.7bg,根據鐵元素守恒可知樣品中鐵元素的質量為0.7bg,所以樣品中Fe元素的質量分數為$\frac{0.7b}{a}$=$\frac{7b}{10a}$,
故答案為:$\frac{7b}{10a}$.
點評 本題考查了鐵及其化合物性質的分析應用,主要是流程分析理解和反應過程的判斷,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | V=2.24L | |
| B. | 參加反應的HCl為0.18mol | |
| C. | 無法確定最終生成含鉀化合物的數量是多少 | |
| D. | 6.32g KMnO4粉末若直接與足量濃鹽酸反應可得到2.24L Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 固定和利用CO2,能有效地利用資源,并減少空氣中的溫室氣體.工業上正在研究利用CO2來生產甲醇燃料的方法,該方法的化學方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ;某科學實驗將6mol CO2和8mol H2充入一容積為2L的密閉容器中,測得H2的物質的量隨時間變化如圖中實線所示(圖中字母后的數字表示對應的坐標):回答下列問題:
固定和利用CO2,能有效地利用資源,并減少空氣中的溫室氣體.工業上正在研究利用CO2來生產甲醇燃料的方法,該方法的化學方程式是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ;某科學實驗將6mol CO2和8mol H2充入一容積為2L的密閉容器中,測得H2的物質的量隨時間變化如圖中實線所示(圖中字母后的數字表示對應的坐標):回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a=10、b=9.2 | B. | a<10、b>9.2 | C. | a>10、b=9.2 | D. | a>10、b<9.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
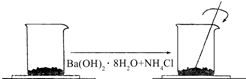 在一個小燒杯里,加入 40g Ba(OH)2•8H2O粉末,將小燒杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶體,并用玻璃棒迅速攪拌.如圖所示.回答下列問題:
在一個小燒杯里,加入 40g Ba(OH)2•8H2O粉末,將小燒杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶體,并用玻璃棒迅速攪拌.如圖所示.回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com