
【題目】已知X、Y、Z、W四種物質存在如圖轉化關系,下列判斷正確的是
![]()
A.若W是一種常見的金屬單質,則X可能為![]()
B.若W為強堿,Y為白色難溶于水的固體,則工業上可以電解X的水溶液來制取其中所含的金屬
C.若W固體俗稱干冰,則Y晶體中的陰、陽離子個數比為1∶1
D.若W是![]() ,則Y一定是酸性氧化物
,則Y一定是酸性氧化物
 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:
【題目】某相對分子質量為40的鏈狀不飽和烴A,能發生如下轉化:
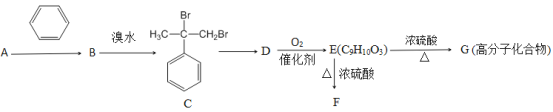
已知:①羥基所連接的碳原子上無氫原子時,難以發生催化氧化;②E能與NaHCO3溶液反應產生氣體;③F為酯類化合物。
(1)A的分子式為_____________,A轉化為B的反應類型為______________,C轉化為D的反應條件為_________________。
(2)B中所含有的官能團的名稱為_____________,B中共平面的原子最多有________個。
(3)寫出D轉化為E的化學方程式:__________________
(4)與E互為同分異構體的芳香族化合物K,已知:①K與E具有相同的官能團;②K不能與FeCl3溶液發生顯色反應;③K有二個取代基,則符合上述條件的K共有_________。(填字母代號)
a.3種 b.6種 c. 9種 d.12種
(5)F的結構簡式為_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.在鋅與某濃度的鹽酸反應的實驗中,實驗員得到下面的結果:
鋅的質量(g) | 鋅的形狀 | 溫度(℃) | 溶解于酸花的時間(s) | |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 35 | 50 |
E | 2 | 薄片 | 45 | 25 |
F | 2 | 粉末 | 15 | 5 |
(1)寫出實驗中發生反應的離子方程式:___________,該反應是_____反應(填“放熱”或“吸熱”);
(2)仔細觀察A~F的實驗數據對比,你可以得到關于溫度影響反應速率結論,用此結論,計算:55℃時,2g鋅薄片溶解于酸中需花____ s。
(3)對比結果B與F,解釋結果F那么快的原因:________
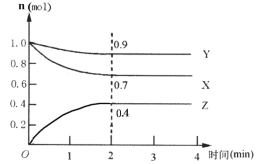
Ⅱ.某可逆反應在某體積為5L的密閉容器中進行,在從0~4分鐘各物質的量的變化情況如圖所示(X、Y、Z均為氣體)。
(1)該反應的的化學方程式為_______;
(2)反應開始至2分鐘時,X的平均反應速率為______;
(3)能說明該反應已達到平衡狀態的是______;
a.每消耗3molX,同時消耗1molY
b.容器內壓強保持不變
c.Z的濃度不再變化
d.容器內混合氣體的密度保持不變
(4)由下圖求得平衡時Y的轉化率為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中學化學常見物質A~I的轉化關系如框圖所示,其中A為化合物,B為常見金屬單質,H的焰色反應為黃色,Y不使品紅溶液褪色。(部分反應條件、溶劑及產物已略去)
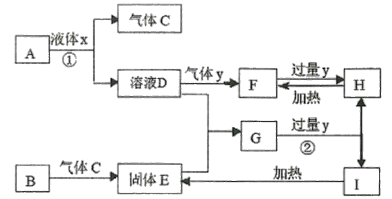
(1)反應①、②的離子方程式________________、__________。
(2)現有含0.10 mol H的溶液,要使其轉化成含0.10 mol F的溶液,則:
①若只能加入0.050 mol的某物質,該物質可能是_________________ (填化學式,寫1種)。
②若只能加入0.10 mol的某物質,該物質可能是_________________ (填化學式,寫1種)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎂與稀硝酸的反應為:Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O
(1)配平上述化學方程式并用“雙線橋法”表示該反應中電子轉移的方向和數目。________
(2)該反應中,還原產物是_________,HNO3表現了______________(選填“還原性”、“氧化性”、“酸性”、“堿性”)。
(3)若反應過程中轉移的電子為0.6 mol,則被還原的硝酸物質的量為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】蕪湖即將成為安徽省第二個擁有軌道交通的城市。蕪湖軌道交通(如圖)采用單軌系統,當單軌電車開動時,車上裸露的“電刷”沿架空電線滑動,這種運行方式具有便捷、污染小的特點。下列有關說法不正確的一項是

A.“電刷”材料中很有可能含有石墨
B.“電刷”材料一定含有導電性、潤滑性極好的材料
C.采用單軌系統提高了能量的利用效率,符合綠色化學的要求
D.單軌列車運行時,供電原理與原電池類似
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家哈邁德·澤維爾研究運用激光技術觀察化學反應時分子中原子的運動,在研究中證實光可誘發如圖所示的變化。下列敘述不正確的是

A.兩物質的分子式相同
B.兩物質均可發生加成反應
C.兩物質分子中所有原子不可能處于同一平面上
D.兩物質都不能生成高分子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(I)我國化工專家侯德榜的“侯氏制堿法” 又叫“聯合制堿法”以NaCl、NH3、CO2等為原料先制得NaHCO3,進而生產出純堿Na2CO3,有關反應的化學方程式:
(1)____;
(2)____。
(II).取一定量的酸性KMnO4溶液依次進行下列實驗,有關現象記錄如下:①滴加適量H2O2,紫紅色褪去,并有氣泡產生;②再加入適量的PbO2固體,固體溶解,溶液又變為紫紅色; ③最后通入足量的SO2氣體。請回答下列問題:
(1)KMnO4、H2O2、PbO2氧化性由強到弱的順序為__;
(2)實驗③中的現象為__;
(3)實驗①、②中反應的離子方程式分別是__、___。
(III)鋁與NaOH溶液反應同溫同壓下,在體積和濃度均為100mL2mol·L1的鹽酸和NaOH溶液中各加入等質量的Al,產生氣體的體積之比為5∶6,則所加Al的質量為__g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲酸(HCOOH)是還原性酸,又稱作蟻酸,常用于橡膠、醫藥、染料、皮革等工業生產。某化學興趣小組在分析甲酸的組成和結構后,對甲酸的某些性質進行了探究。請回答下列問題。
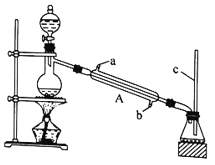
I.甲酸能與醇發生酯化反應
該興趣小組用如上圖所示裝置進行甲酸(HCOOH)與甲醇(CH3OH)的酯化反應實驗:
有關物質的性質如下:
沸點/℃ | 密度(g·cm-3) | 水中溶解性 | |
甲醇 | 64.5 | 0.79 | 易溶 |
甲酸 | 100.7 | 1.22 | 易溶 |
甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(1)裝置中,儀器A的名稱是_________________,長玻璃管c的作用是__________________________。
(2)甲酸和甲醇進行酯化反應的化學方程式為____________________________________________。
(3)要從錐形瓶內所得的混合物中提取甲酸甲酯,可采用的方法為__________________________________。
II.甲酸能脫水制取一氧化碳

(1)利用上圖裝置制備并收集CO氣體,其正確的連接順序為a→__________(按氣流方向從左到右,用小寫字母表示)。
(2)裝置B的作用是__________________________________。
(3)一定條件下,CO能與NaOH固體發生反應:CO+NaOH ![]() HCOONa。
HCOONa。
①為了證明“CO與NaOH固體發生了反應”,設計下列定性實驗方案:取固體產物,配成溶液,___________。
②測定產物中甲酸鈉(HCOONa)的純度:準確稱取固體產物8,0g配制成100mL溶液,量取20.00mL該溶液于錐形瓶中,再加入___________作指示劑,用1.5mol/L的鹽酸標準溶液滴定剩余的NaOH,平行滴定三次,平均消耗鹽酸的體積為5.05mL,則產物中甲酸鈉的質量分數為_______(計算結果精確到0.1%)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com