
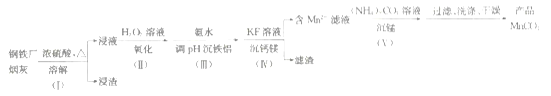
【題目】一種利用鋼鐵廠煙灰(含Fe、Mn、SiO2,少量的Al2O3、CaO及MgO)制備MnCO3的工藝流程如下:
已知25℃時,下列難溶物的溶度積常數:
難溶物 | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0×10-11 | 6.4×10-9 | 2.2×10-11 | 1.9×10-13 |
回答下列問題:
(1)步驟(Ⅰ)浸渣的主要成分是______________(填化學式)。
(2)步驟(Ⅱ)加H2O2溶液時反應的離子方程式為________________;
加氨水調節pH沉鐵鋁時,步驟(Ⅲ)應調節的pH適宜范圍為____________。(部分金屬離子開始沉淀與沉淀完全的pH范圍如下)
金屬離子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
沉淀pH范圍 | 7.6~9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6~11.1 |
(3)步驟(Ⅳ)用KF溶液沉鈣鎂時,要使c(Ca2+)、c(Mg2+)均小于1×10-6mol·L-1,則應控制反應液中c(F-)>___________mol·L-1;反應MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常數K=___________。
CaF2(s)+Mg2+的平衡常數K=___________。
(4)步驟Ⅴ沉錳時,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2,溶液的pH對MnCO3產率的影響如圖所示;pH=7,按投料比n[(NH4)2CO3]/n(Mn2+)=2,反應溫度對MnCO3產率的影響如圖所示。
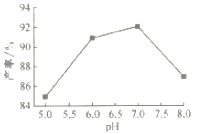
①上圖中,在pH<7.0時,pH越小產率____________(填“越高”或“越低”;在pH>7.0時,pH越大產率越低且純度也降低,其原因是___________________。

②上圖中,溫度高于60℃時,溫度越高產率越低且純度也越低,主要原因是______________。
【答案】SiO2 2Fe2++H2O2+2H+-2Fe3++2H2O 5.2~8.3 0.08 160 越低 部分MnCO3轉化為溶解度更小的Mn(OH)2 溫度越高MnCO3水解程度越大[或溫度升高,(NH4)2CO3和MnCO3也會熱分解]
【解析】
由流程圖可知,向鋼鐵廠煙灰中加入濃硫酸并加熱,煙灰中Fe、Mn、Al2O3、CaO及MgO溶解,酸性氧化物SiO2不溶解,過濾得到浸液和浸渣;向浸液中加入雙氧水溶液,將亞鐵離子氧化為鐵離子,加入氨水調節溶液pH,鐵離子和鋁離子轉化為氫氧化鐵和氫氧化鋁沉淀,加入氟化鉀溶液,將鈣離子和鎂離子轉化為氟化鈣和氟化鎂沉淀,過濾得到含錳離子的濾液和濾渣;向含錳離子的濾液中加入碳酸銨溶液,錳離子轉化為碳酸錳沉淀,過濾、洗滌、干燥得到碳酸錳產品。
(1)步驟(Ⅰ)浸渣的主要成分是不與濃硫酸反應的酸性氧化物二氧化硅,故答案為:SiO2;
(2)步驟(Ⅱ)加H2O2溶液時,雙氧水將溶液中的亞鐵離子氧化為鐵離子,反應的離子方程式為2Fe2++H2O2+2H+-2Fe3++2H2O;加入氨水的目的是調節溶液pH,使溶液中鐵離子和鋁離子轉化為氫氧化鐵和氫氧化鋁沉淀而除去,而錳離子不能沉淀,由題給表格數據可知,應調節的pH適宜范圍為5.2~8.3,故答案為:2Fe2++H2O2+2H+-2Fe3++2H2O;5.2~8.3;
(3)用KF溶液沉鈣鎂時,溶解度小的CaF2沉淀先生成,MgF2沉淀后生成,則c(Mg2+)小于1×10-6mol·L-1時,溶液中c(F-)>![]() mol/L;反應MgF2(s)+Ca2+
mol/L;反應MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常數K=
CaF2(s)+Mg2+的平衡常數K=![]() =160,故答案為:0.08;160;
=160,故答案為:0.08;160;
(4) ①由圖可知,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2時,在pH<7.0時,pH越小MnCO3產率越小;由表格所給溶度積可知,pH>7.0時,溶液堿性增強, MnCO3部分會轉化為溶解度更小的Mn(OH)2,導致產率和純度降低,故答案為:越低;部分MnCO3轉化為溶解度更小的Mn(OH)2;
②由圖可知,60℃時,MnCO3產率最大,溫度高于60℃時,溫度升高MnCO3水解程度越大,(NH4)2CO3和MnCO3也會熱分解,導致產率和純度降低,故答案為:溫度越高MnCO3水解程度越大[或溫度升高,(NH4)2CO3和MnCO3也會熱分解]。


科目:高中化學 來源: 題型:
【題目】(1)按照系統命名法寫出下列烷烴的名稱:
 _____
_____
 ___
___
 ___
___
 _____
_____
(2)根據下列有機物的名稱,寫出相應的結構簡式:
①2,4二甲基戊烷_________________________
②2,2,5三甲基3乙基己烷__________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上制取純硅的主要反應:SiCl4 + 2H2 ![]() Si + 4HCl。該反應中,被還原的物質是______(填化學式),作為還原劑的物質是______(填化學式);若反應中生成了1 mol Si,則消耗H2 ______mol。
Si + 4HCl。該反應中,被還原的物質是______(填化學式),作為還原劑的物質是______(填化學式);若反應中生成了1 mol Si,則消耗H2 ______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校科學興趣小組探究二氧化碳與過氧化鈉反應是否有氧氣生成,設計了如圖的實驗裝置.B中盛有飽和碳酸氫鈉溶液,目的是除去二氧化碳中混有的氯化氫氣體,E為收集氧氣裝置.

(1)寫出裝置A中發生反應的化學方程式____________。
(2)C中盛有____________,目的是_____________。
(3)寫出裝置D中發生反應的化學方程式__________。
(4)指出裝置E的錯誤_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中實線是元素周期表的部分邊界,其中上邊界并未用實線標出。

根據信息回答下列問題。
(1)周期表中基態Ga原子的最外層電子排布式為 。
(2)Fe元素位于周期表的 區;Fe與CO易形成配合物Fe(CO)5,在Fe(CO)5中鐵的化合價為 ;已知:原子數目和電子總數(或價電子總數)相同的微粒互為等電子體,等電子體具有相似的結構特征。與CO分子互為等電子體的分子和離子分別為 和 (填化學式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3雜化的分子有 。
(4)根據VSEPR理論預測ED4-離子的空間構型為 。B、C、D、E原子相互化合形成的分子中,所有原子都滿足最外層8電子穩定結構的分子的電子式為 (寫2種)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中,反應2X(g)+Y2(g)![]() 2XY(g);△H<0,達到甲平衡.在僅改變某一條件后,達到乙平衡,下列分析正確的是
2XY(g);△H<0,達到甲平衡.在僅改變某一條件后,達到乙平衡,下列分析正確的是

A. 圖I中,甲、乙的平衡常數分別為K1、K2,則K1<K2
B. 圖Ⅱ中,平衡狀態甲與乙相比,平衡狀態甲的反應物轉化率低
C. 圖Ⅱ中,t時間是增大了壓強
D. 圖Ⅲ是反應分別在甲、乙條件下達到平衡,說明乙溫度高于甲
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三個密閉容器中分別充入N2、H2、O2三種氣體,以下各種情況下排序正確的是( )
A. 當它們的溫度和壓強均相同時,三種氣體的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 當它們的溫度和密度都相同時,三種氣體的壓強:p(H2)>p(N2)>p(O2)
C. 當它們的質量和溫度、壓強均相同時,三種氣體的體積:V(O2)>V(N2)>V(H2)
D. 當它們的壓強和體積、溫度均相同時,三種氣體的質量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化硫一空氣質子交換膜燃料電池將化學能轉變成電能的同時,實現了制硫酸、發電、環保三位一體的結合,其原理如圖所示。下列說法錯誤的是

A. 負極的電極反應式為SO2+2H2O-2e-=SO42-+4H+
B. 反應總式為2SO2+O2+2H2O=2H2SO4
C. 質子的移動方向為從電極B到電極A
D. SO2氣流速度的大小可能影響電池的電動勢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表中實線是元素周期表的部分邊界,其中上邊界并未用實線標出。

根據信息回答下列問題。
(1)周期表中基態Ga原子的最外層電子排布式為 。
(2)Fe元素位于周期表的 區;Fe與CO易形成配合物Fe(CO)5,在Fe(CO)5中鐵的化合價為 ;已知:原子數目和電子總數(或價電子總數)相同的微粒互為等電子體,等電子體具有相似的結構特征。與CO分子互為等電子體的分子和離子分別為 和 (填化學式)。
(3)在CH4、CO2、CH3OH中,碳原子采取sp3雜化的分子有 。
(4)根據VSEPR理論預測ED4-離子的空間構型為 。B、C、D、E原子相互化合形成的分子中,所有原子都滿足最外層8電子穩定結構的分子的電子式為 (寫2種)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com