



科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
(16分)硫酸亞鐵晶體(FeSO4·7H2O)在醫藥上作補血劑。某課外研究小組測定該補血劑中鐵元素的含量,實驗步驟如下:
請回答下列問題:
(1)證明步驟①濾液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,該過程的現象為: 。
(2)步驟②加入過量H2O2的目的: 。
(3)步驟③中反應的離子方程式: 。
(4)步驟④中一系列處理的操作步驟:過濾、 、灼燒、 、稱量。
(5)若實驗無損耗,則每片補血劑含鐵元素的質量 g。
(6)該小組有些同學認為用KMnO4溶液滴定也能進行鐵元素含量的測定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①實驗前,首先要精確配制一定物質的量濃度的KMnO4溶液250mL,配制時需要的儀器除天平、玻棒、燒杯、膠頭滴管外,還需 。
②上述實驗中的KMnO4溶液需要酸化,用于酸化的酸是__ __。
a.稀硝酸 b.稀硫酸 c.稀鹽酸 d.濃硝酸
③滴定到終點時的顏色為 色。
查看答案和解析>>
科目:高中化學 來源:2012屆安徽省安師大附中高三上學期第四次模擬考試化學試卷 題型:實驗題
(16分)硫酸亞鐵晶體(FeSO4·7H2O)在醫藥上作補血劑。某課外研究小組測定該補血劑中鐵元素的含量,實驗步驟如下:
 請回答下列問題:
請回答下列問題:
(1)證明步驟①濾液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,該過程的現象為: 。
(2)步驟②加入過量H2O2的目的: 。
(3)步驟③中反應的離子方程式: 。
(4)步驟④中一系列處理的操作步驟:過濾、 、灼燒、 、稱量。
(5)若實驗無損耗,則每片補血劑含鐵元素的質量 g。
(6)該小組有些同學認為用KMnO4溶液滴定也能進行 鐵元素含量的測定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
鐵元素含量的測定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①實驗前,首先要精確配制一定物質的量濃度的KMnO4溶液250mL,配制時需要的儀器除天平、玻棒、燒杯、膠頭滴管外,還需 。
②上述實驗中的KMnO4溶液需要酸化,用于酸化的酸是__ __。
a.稀硝酸 b.稀硫酸 c.稀鹽酸 d.濃硝酸
③滴定到終點時的顏色為 色。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年安徽省高三上學期第四次模擬考試化學試卷 題型:實驗題
(16分)硫酸亞鐵晶體(FeSO4·7H2O)在醫藥上作補血劑。某課外研究小組測定該補血劑中鐵元素的含量,實驗步驟如下:
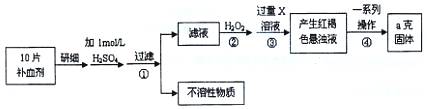
請回答下列問題:
(1)證明步驟①濾液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,該過程的現象為: 。
(2)步驟②加入過量H2O2的目的: 。
(3)步驟③中反應的離子方程式: 。
(4)步驟④中一系列處理的操作步驟:過濾、 、灼燒、 、稱量。
(5)若實驗無損耗,則每片補血劑含鐵元素的質量 g。
(6)該小組有些同學認為用KMnO4溶液滴定也能進行鐵元素含量的測定。(5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①實驗前,首先要精確配制一定物質的量濃度的KMnO4溶液250mL,配制時需要的儀器除天平、玻棒、燒杯、膠頭滴管外,還需 。
②上述實驗中的KMnO4溶液需要酸化,用于酸化的酸是__ __。
a.稀硝酸 b.稀硫酸 c.稀鹽酸 d.濃硝酸
③滴定到終點時的顏色為 色。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年上海市高三第一次考試化學試卷 題型:實驗題
硫酸亞鐵晶體(FeSO4·7H2O)在醫藥上作補血劑。某課外研究小組測定該補血劑中鐵元素的含量,實驗步驟如下:

請回答下列問題:
(1)證明步驟①濾液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,該過程的現象為: 。
(2)步驟②加入過量H2O2的目的: 。
(3)步驟③中反應的離子方程式: 。
(4)步驟④中一系列處理的操作步驟:過濾、 、灼燒、 、稱量。
(5)若實驗無損耗,則每片補血劑含鐵元素的質量 g。
(6)該小組有些同學認為用KMnO4溶液滴定也能進行鐵元素含量的測定。
(5Fe2++MnO—4+8H+→5Fe3++Mn2++4H2O)
①實驗前,首先要精確配制一定物質的量濃度的KMnO4溶液250mL,配制時需要的儀器除天平、玻棒、燒杯、膠頭滴管外,還需
②上述實驗中的KMnO4溶液需要酸化,用于酸化的酸是____。
a.稀硝酸 b.稀硫酸 c.稀鹽酸 d.濃硝酸
③滴定到終點時的顏色為 色。
(7)正常人每天應補充14mg左右的鐵。其中絕大部分來自于食物。如果全部通過服用含FeSO4·7H2O的片劑來補充鐵,則正常人每天服需用含 mg FeSO4·7H2O的片劑。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com