
(1)寫熱化學方程式:
在101kPa時,H
2在1.00molO
2中完全燃燒生成2.00mol液態H
2O,放出571.6kJ的熱量,表示H
2燃燒熱的熱化學方程式
H
2(g)+
O
2(g)=H
2O(l)△H=-285.8KJ/mol
H
2(g)+
O
2(g)=H
2O(l)△H=-285.8KJ/mol
;
1.00L 1.00mol/L H
2SO
4溶液與2.00L 1.00mol/L NaOH溶液完全反應,放出114.6kJ的熱量,該反應的反應熱為
-11.46kJ/mol
-11.46kJ/mol
,表示其中和熱的熱化學方程式為
NaOH(aq)+
H
2SO
4(aq)=
Na
2SO
4(aq)+H
2O(l)△H=-57.3kJ/mol
NaOH(aq)+
H
2SO
4(aq)=
Na
2SO
4(aq)+H
2O(l)△H=-57.3kJ/mol
.
(2)恒溫條件下,將2.0molSO
2與amolO
2混合通入一個2L密閉容器中,發生如下反應:2SO
2(g)+O
2(g)2SO
3(g).反應20s后達平衡時,測得容器內n(SO
3)=1.3mol,n(O
2)=3.0mol.則a的值為:
3.65
3.65
;平衡時SO
2的轉化率為:
65%
65%
.用SO
3表示該化學反應速率為:
0.0325mol/(L?min)
0.0325mol/(L?min)
.
(3)根據如圖所示原電池裝置回答下列問題
負極材料:
鋅
鋅
,電極反應式:
Zn-2e-═Zn2+
Zn-2e-═Zn2+
,電子由
負
負
電極經外電路流向
正
正
電極.

 (1)寫熱化學方程式:
(1)寫熱化學方程式: 2SO3(g).
2SO3(g).

 閱讀快車系列答案
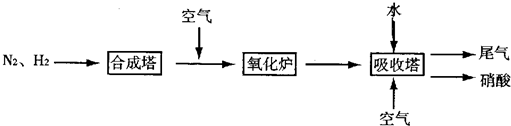
閱讀快車系列答案 隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.
隨著大氣污染的日趨嚴重,國家擬于“十二五”期間,將二氧化硫(SO2)排放量減少8%,氮氧化物(NOx)排放量減少10%.目前,消除大氣污染有多種方法.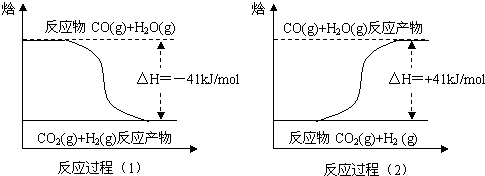

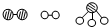 分別表示N2、H2、NH3.圖⑤表示生成的NH3離開催化劑表面,圖②和圖③的含義分別為
分別表示N2、H2、NH3.圖⑤表示生成的NH3離開催化劑表面,圖②和圖③的含義分別為