
【題目】研究催化劑對化學反應有重要意義。為探究催化劑對雙氧水分解的催化效果,某研究小組做了如下實驗:
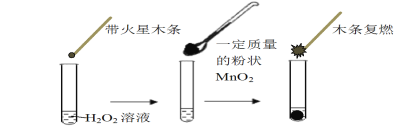
(1)甲同學欲用上圖所示實驗來證明MnO2是H2O2分解反應的催化劑,寫出該反應的化學方程式 。
(2)為探究MnO2的質量對催化效果的影響,乙同學分別量取50 mL 1% H2O2加入容器中,在一定質量范圍內,加入不同質量的MnO2,測量所得氣體體積,數據如下:
MnO2的質量/g | 0.1 | 0.2 | 0.4 |
40s末O2體積/mL | 49 | 61 | 86 |
由此得出的結論是 。
(3)為分析Fe3+和Cu2+對H2O2分解反應的催化效果,丙同學設計如下實驗(三支試管中均盛有10 mL 5% H2O2 ) :
試管 | Ⅰ | Ⅱ | Ⅲ |
滴加試劑 | 5滴0.1 mol·L-1 FeCl3 | 5滴0.1 mol·L-1 CuCl2 | 5滴0.3 mol·L-1 NaCl |
產生氣 泡情況 | 較快產生細小氣泡 | 緩慢產生細小氣泡 | 無氣泡產生 |
結論是 ,實驗Ⅲ的目的是 。
(4)查閱資料得知:將作為催化劑的FeCl3溶液加入H2O2溶液后,溶液中會發生兩個氧化還原反應,且兩個反應中H2O2均參加了反應,試從催化劑的角度分析,這兩個氧化還原反應的化學方程式分別是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 。
【答案】(1)2H2O2=2H2O+O2 ↑
(2)在一定質量范圍內,增加MnO2的質量,化學反應速率加快
(3)Fe3+和Cu2+對H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好
對比實驗,說明Cl-對的H2O2分解沒有催化效果
(4)2FeCl2+ H2O2+2HCl=2FeCl3+2H2O
【解析】
試題分析:(1)過氧化氫分解生成水和氧氣,方程式為2H2O2![]() 2H2O+O2↑;(2)根據測得的數據,在一定質量范圍內,增加MnO2的質量,化學反應速率加快;(3)根據表格數據,Fe3+和Cu2+對H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好;實驗Ⅲ的目的是對比實驗,說明Cl-對的H2O2分解沒有催化效果;(4)催化劑在反應前后質量不變,2FeCl3 + H2O2 = 2FeCl2 + O2↑+ 2HCl反應消耗FeCl3,在另一個反應中生成FeCl3,方程式為2FeCl2+ H2O2+2HCl=2FeCl3+2H2O。
2H2O+O2↑;(2)根據測得的數據,在一定質量范圍內,增加MnO2的質量,化學反應速率加快;(3)根據表格數據,Fe3+和Cu2+對H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好;實驗Ⅲ的目的是對比實驗,說明Cl-對的H2O2分解沒有催化效果;(4)催化劑在反應前后質量不變,2FeCl3 + H2O2 = 2FeCl2 + O2↑+ 2HCl反應消耗FeCl3,在另一個反應中生成FeCl3,方程式為2FeCl2+ H2O2+2HCl=2FeCl3+2H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】用壓強傳感器探究生鐵在pH=2和pH=4醋酸溶液中發生腐蝕的裝置及得到的圖像如下:
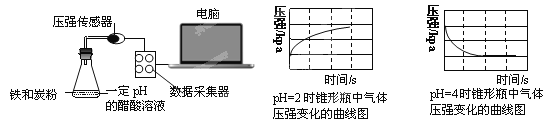
分析圖像,以下結論錯誤的是
A.溶液pH≤2時,生鐵發生析氫腐蝕
B.生鐵的腐蝕中化學腐蝕比電化學腐蝕更普遍
C.在酸性溶液中生鐵可能發生吸氧腐蝕
D.兩溶液中負極反應均為:Fe – 2e-===Fe2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,參照元素在表中的位置,請用化學用語回答下列問題:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名稱為 ;⑨的最高價含氧酸的化學式為 。
(2)①和⑦兩種元素的原子按1:1組成的常見化合物的結構式為 。
(3)③、④、⑦、⑧的簡單離子半徑由大到小的順序為 。(用離子符號表示)
(4)②、④的最高價氧化物的水化物之間發生反應的離子方程式 。
(5)用電子式表示③和⑨組成的化合物的形成過程 。
(6)海帶中含有⑩元素,海帶灰中含有該元素的簡單陰離子,在硫酸酸化下,可用雙氧水將其氧化為單質。寫出該反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為研究金屬腐蝕的條件和速率,某課外小組學生用金屬絲將三根大小相同的鐵釘分別固定在圖示的三個裝置中,再放置于玻璃鐘罩里保存相同的一段時間。下列對實驗結束時現象的描述不正確的是( )
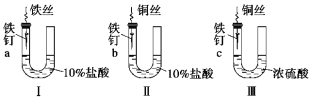
A.裝置Ⅰ左側的液面一定會下降 B.左側液面裝置Ⅰ比裝置Ⅱ的低
C.裝置Ⅱ中的鐵釘腐蝕最嚴重 D.裝置Ⅲ中的鐵釘幾乎沒被腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在下列操作中,一般情況下不能相互接觸的是( )
A. 用膠頭滴管向試管內滴加液體時,膠頭滴管尖端與試管內壁
B. 分液時,分液漏斗下端與燒杯內壁
C. 過濾時,燒杯內壁與漏斗下端
D. 過濾時,玻璃棒與三層濾紙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.在分子中,兩個成鍵的原子間的距離叫做鍵長
B.H—Cl的鍵能為431.8 kJ/mol,H—I的鍵能為298.7 kJ/mol,這可以說明HCl分子比HI分子穩定
C.含有極性鍵的分子一定是極性分子
D.鍵能越大,表示該分子越容易受熱分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將鎂片、鋁片平行插入到一定濃度的NaOH溶液中,用導線連接成閉合回路,該裝置在工作時,下列敘述正確的是( )
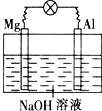
A.鎂比鋁活潑,鎂失去電子被氧化成Mg2+
B.鋁是電池負極,開始工作時溶液中會立即有白色沉淀生成
C.該裝置的內、外電路中,均是電子的定向移動形成電流
D.該裝置開始工作時,鋁片表面的氧化膜可不必處理
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(2014大綱卷)A、B、D、E、F為短周期元素,非金屬元素A最外層電子數與其周期數相同,B的最外層電子數是其所在周期數的2倍。B 在D中充分燃燒能生成其最高價化合物BD2。E+與D2-具有相同的電子數。A在F中燃燒,產物溶于水得到一種強酸。回答下列問題:
(1)A在周期表中的位置是 ,寫出一種工業制備單質F的離子方程式 。
(2)B、D、E組成的一種鹽中,E的質量分數為43%,其俗名為 ,其水溶液與F單質反應的化學方程式為 ;在產物中加入少
量KI,反應后加人CC14并振蕩,有 機層顯 色。
(3)由這些元素組成的物質,其組成和結構信息如下表:
物質 | 組成和結構信息 |
a | 含有A的二元離子化合物 |
b | 含有非極性共價鍵的二元離子化合物,且原子數之比為1:1 |
c | 化學組成為BDF2 |
d | 只存在一種類型作用力且可導電的單質晶體 |
a的化學式為 ;b的化學式為 ;;c的電子式為 ;
d的晶體類型是 。
(4)由A和B、D元素組成的兩種二元化合物形成一類新能源物質。一種化合物分子通過 鍵構
成具有空腔的固體;另一種化合物(沼氣的主要成分)分子進入該空腔,其分子的空間結構為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com