
【題目】草酸(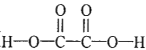 )在工業(yè)上可作漂白劑、鞣革劑,也是實驗室常用試劑。
)在工業(yè)上可作漂白劑、鞣革劑,也是實驗室常用試劑。
(1)已知草酸中相關化學鍵的鍵能數(shù)據(jù)如下表:

一定條件下發(fā)生反應H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。
H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。
(2)現(xiàn)將0.50mol無水草酸放入10L的密閉容器中,分別在T1、T2時進行上述反應(體系內物質均為氣態(tài)),測得n(H2C2O4)隨時間變化的數(shù)據(jù)如下表:

①溫度:T1_________T2(填“>”、“<”或“=”);
②T2時0~20min平均反應速率v(CO)= _________;
③該反應達到平衡的標志為_________ (填序號);
a消耗H2C2O4和生成H2O的物質的量相等 b.氣體密度不變
c混合氣體的平均摩爾質量不變 d.體系中![]() 不變
不變
④T2時,反應至20min時再加入0.5molH2C2O4,反應達平衡時H2C2O4物質的量_________0.36mol(填“>”“<”或“=”)。
(3)室溫下利用H2C2O4溶液和酸性KMnO4溶液的反應探究外界條件對反應速率的影響,設計方案如下:

①上述反應的離子方程式為_________;
②分析數(shù)據(jù)可得到的結論是_________;
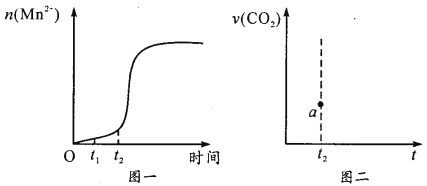
③該實驗中若n(Mn2+)隨時間變化趨勢如圖一所示,請于圖二畫出t2 后生成CO2的速率圖像(從a點開始作圖)并說明理由_________。
 。
。
【答案】2a+c-b < 0.0016mol/(L·min) cd < 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O 其他條件不變時,草酸的濃度越大,反應速率越快 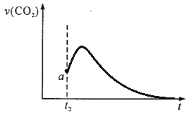 ,錳離子對反應起到催化作用,生成二氧化碳的速率會突然加快,隨著反應的進行,溶液中溶質的濃度逐漸減小,生成二氧化碳的速率減慢,最后幾乎為0
,錳離子對反應起到催化作用,生成二氧化碳的速率會突然加快,隨著反應的進行,溶液中溶質的濃度逐漸減小,生成二氧化碳的速率減慢,最后幾乎為0
【解析】
(1)根據(jù)△H=反應物的總鍵能-生成物的總鍵能計算;
(2)①溫度越高,化學反應速率越快;②首先可以計算T2時0~20min平均反應速率v(H2C2O4),再結合方程式H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g),計算v(CO);③根據(jù)化學平衡狀態(tài)的特征和標志分析判斷;④根據(jù)表格數(shù)據(jù),T2時,反應至20min時反應達到平衡,再加入0.5molH2C2O4,相當于增大壓強,據(jù)此分析判斷;
H2O(g)+CO(g)+CO2(g),計算v(CO);③根據(jù)化學平衡狀態(tài)的特征和標志分析判斷;④根據(jù)表格數(shù)據(jù),T2時,反應至20min時反應達到平衡,再加入0.5molH2C2O4,相當于增大壓強,據(jù)此分析判斷;
(3)①反應后H2C2O4轉化為CO2逸出,KMnO4轉化為MnSO4,結合化合價升降守恒寫出并配平反應的化學方程式;②表格中溶液的總體積相同,高錳酸鉀的體積相等,草酸的體積不同,結合溶液褪色需要的時間分析解答;③根據(jù)n(Mn2+)隨時間變化趨勢圖可知,t2 時反應速率突然加快,可能是生成的錳離子對反應起到催化作用,因此生成二氧化碳的速率也會突然加快,隨著反應的進行,溶液中溶質的濃度逐漸減小,因此生成二氧化碳的速率減慢,最后幾乎為0,據(jù)此分析解答。
(1)反應物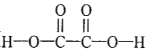 中含有2個H-O,2個C-O,2個C=O和1個C-C;生成物H2O+CO+CO2中含有2個H-O,1個
中含有2個H-O,2個C-O,2個C=O和1個C-C;生成物H2O+CO+CO2中含有2個H-O,1個![]() ,2個C=O,H2C2O4(g)
,2個C=O,H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g) △H=反應物的總鍵能-生成物的總鍵能=2E(C-O)+E(C-C)-E(
H2O(g)+CO(g)+CO2(g) △H=反應物的總鍵能-生成物的總鍵能=2E(C-O)+E(C-C)-E(![]() )=(2a+c-b)kJ/mol,故答案為:2a+c-b;
)=(2a+c-b)kJ/mol,故答案為:2a+c-b;
(2)①溫度越高,化學反應速率越快,根據(jù)表格數(shù)據(jù)可知,相同時間內,n(H2C2O4)在T2時變化大,反應速率快,因此溫度:T1<T2,故答案為:<;
②T2時0~20min平均反應速率v(H2C2O4)=![]() =0.0016mol/(L·min),故方程式H2C2O4(g)
=0.0016mol/(L·min),故方程式H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g),v(CO)= v(H2C2O4)= 0.0016mol/(L·min),故答案為:0.0016mol/(L·min);
H2O(g)+CO(g)+CO2(g),v(CO)= v(H2C2O4)= 0.0016mol/(L·min),故答案為:0.0016mol/(L·min);
③a. H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g),消耗H2C2O4和生成H2O的物質的量始終相等,不能說明達到平衡狀態(tài),錯誤;b.氣體的質量不變,氣體的體積不變,因此氣體密度始終不變,不能說明達到平衡狀態(tài),錯誤;c.氣體的質量不變,氣體的物質的量是一個變量,當混合氣體的平均摩爾質量不變,說明氣體的物質的量不變,說明反應達到了平衡狀態(tài),正確;d.隨著反應的進行,H2C2O4的物質的量減小,CO的物質的量增大,當體系中
H2O(g)+CO(g)+CO2(g),消耗H2C2O4和生成H2O的物質的量始終相等,不能說明達到平衡狀態(tài),錯誤;b.氣體的質量不變,氣體的體積不變,因此氣體密度始終不變,不能說明達到平衡狀態(tài),錯誤;c.氣體的質量不變,氣體的物質的量是一個變量,當混合氣體的平均摩爾質量不變,說明氣體的物質的量不變,說明反應達到了平衡狀態(tài),正確;d.隨著反應的進行,H2C2O4的物質的量減小,CO的物質的量增大,當體系中![]() 不變,說明正逆反應速率相等,達到了平衡狀態(tài),正確;故選cd;
不變,說明正逆反應速率相等,達到了平衡狀態(tài),正確;故選cd;
④根據(jù)表格數(shù)據(jù),T2時,反應至20min時反應達到平衡,再加入0.5molH2C2O4,相當于增大壓強,平衡逆向移動,反應達平衡時H2C2O4物質的量<0.36mol,
(3)①反應后H2C2O4轉化為CO2逸出,KMnO4轉化為MnSO4,利用化合價升降相等寫出反應的化學方程式為:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,改寫成離子方程式為:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O,故答案為:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O;
②表格中溶液的總體積相同,高錳酸鉀的體積相等,草酸的體積不同,因此本實驗探究了草酸的濃度對反應速率的影響,根據(jù)溶液褪色需要的時間可知,草酸的濃度越大,溶液褪色的時間越少,說明反應速率越快,故答案為:其他條件不變時,草酸的濃度越大,反應速率越快;
③根據(jù)n(Mn2+)隨時間變化趨勢圖可知,t2 時反應速率突然加快,可能是生成的錳離子對反應起到催化作用,因此生成二氧化碳的速率也會突然加快,隨著反應的進行,溶液中溶質的濃度逐漸減小,因此生成二氧化碳的速率減慢,最后幾乎為0,因此生成CO2的速率圖像為 ,故答案為:
,故答案為: ,錳離子對反應起到催化作用,生成二氧化碳的速率會突然加快,隨著反應的進行,溶液中溶質的濃度逐漸減小,生成二氧化碳的速率減慢,最后幾乎為0。
,錳離子對反應起到催化作用,生成二氧化碳的速率會突然加快,隨著反應的進行,溶液中溶質的濃度逐漸減小,生成二氧化碳的速率減慢,最后幾乎為0。


 輕松課堂單元測試AB卷系列答案
輕松課堂單元測試AB卷系列答案 小題狂做系列答案
小題狂做系列答案科目:高中化學 來源: 題型:
【題目】下列實驗操作所對應的現(xiàn)象、結論均正確的是
選項 | 操作 | 現(xiàn)象 | 結論 |
A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 產生白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀為BaSO3,后轉化為BaSO4 |
B | 向含有酚酞的Na2CO3溶液中加入BaCl2溶液 | 溶液顏色變淺 | Na2CO3溶液中水解平衡向右移動 |
C | 用pH試紙測定NaC1和NaF溶液的pH | pH(NaC1)<pH(NaF) | F元素非金屬性強于C1 |
D | 向足量FeI2溶液中滴加2滴氯水,再分別滴加①淀粉溶液②KSCN溶液 | ①溶液變藍 ②無明顯現(xiàn)象 | 還原性:I->Fe2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】要求完成下列問題。
(1)請根據(jù)圖示回答:
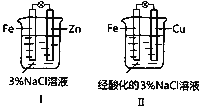
①在Ⅰ中,Zn為_____________極(填“正”或“負”)。
②在Ⅱ中,負極反應式為_____________;電子由________極移向_____________極(填“Fe”或“Cu”),溶液中Na+移向_____________極(填“Fe”或“Cu”)。
③在Ⅱ中,酸是足量的。若產生了標準狀況下5.6 L的氣體,則轉移_________mol e-。
(2)鉛蓄電池的總反應為:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。該電池的負極材料是_________。(填化學式)
2PbSO4+2H2O。該電池的負極材料是_________。(填化學式)
(3)用32 g Cu與300 mL 12 mol/L的濃硝酸反應,當銅全部溶解后,共收集到標準狀況下的氣體11.2 L(不考慮NO2轉化為N2O4),反應消耗的硝酸的物質的量是_____mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量且足量的兩份鋅a、b,分別加入等量的稀H2SO4,同時向a中加入少量的CuSO4溶液,下列各圖表示產生H2的體積(V)與時間(t)的關系,其中正確的是 ( )
A. 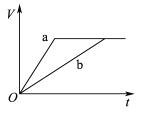 B.
B. 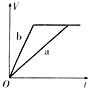
C. 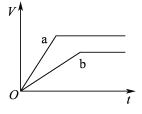 D.
D. 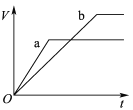
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中,等物質的量的A和B發(fā)生反應:A(g)+2B(g) ![]() 2C(g),反應達平衡時,若混合氣體中A和B的物質的量之和與C的物質的量相等,則這時A的轉化率為( )
2C(g),反應達平衡時,若混合氣體中A和B的物質的量之和與C的物質的量相等,則這時A的轉化率為( )
A. 40% B. 50% C. 60% D. 70%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了除去粗鹽中的Ca2+、Mg2+、SO42-而進行下列五項操作,其中正確的操作順序是( )
①過濾
②加過量NaOH溶液
③加適量鹽酸
④加過量Na2CO3溶液
⑤加過量BaCl2溶液
A.①④②⑤③B.④①②⑤③C.⑤②①④③D.②⑤④①③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某烷烴相對分子質量為86,如果分子中含有3個—CH3、2個—CH2—和1個![]() ,則該結構的烴的一氯取代物(不考慮立體異構)有 ( )
,則該結構的烴的一氯取代物(不考慮立體異構)有 ( )
A. 9種B. 6種C. 5種D. 4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為落實“五水共治”,某工廠擬綜合處理含NH4+廢水和工業(yè)廢氣(主要含N2、CO2、SO2、NO、CO,不考慮其他成分),設計了如下流程:
下列說法不正確的是
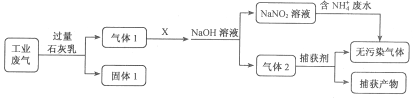
A. 固體1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空氣,且需過量
C. 捕獲劑所捕獲的氣體主要是CO
D. 處理含NH4+廢水時,發(fā)生反應的離子方程式為:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A+、B2+、C-、D2-4種離子具有相同的電子層結構。現(xiàn)有以下排列順序:
①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4種離子的半徑由大到小以及4種元素原子序數(shù)由大到小的順序分別是( )
A.①④B.④①C.②③D.③②
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com