
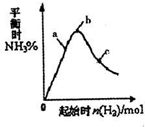
 工業上利用N2和H2可以合成NH3,NH3又可以進一步制備聯氨(N2H4)等.
工業上利用N2和H2可以合成NH3,NH3又可以進一步制備聯氨(N2H4)等.| 1 | 2 |
| 1 |
| 2 |
 ,故答案為:
,故答案為: .
.

科目:高中化學 來源: 題型:
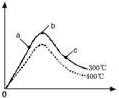
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 7 |
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 | 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 | 2 |
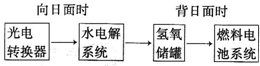
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、工業上利用N2和H2合成氨,實現人工固氮 | B、實驗室用NH4Cl和Ca(0H)2制備NH3 | C、用FeCl3溶液作為“腐蝕液”刻蝕電路銅板 | D、用Na2O2作潛水艇的供氧劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com