
分析 酸的電離平衡常數越小,其對應的酸根離子水解程度越大,則相同濃度的鈉鹽溶液的pH越高;
根據電離平衡常數知,酸的電離平衡常數大小順序是:H2SO3>HSO3->H2CO3>HCO3-,則酸根離子水解程度大小順序是CO32->HCO3->SO32->HSO3-,弱酸根離子都水解但程度都較小,據此判斷各離子濃度大小.
解答 解:H2SO3 Ki1=1.54×10-2,Ki2=1.02×10-7,HClOKi1=2.95×10-8 ,說明ClO-水解程度大于SO32-,0.1mol/L NaClO溶液的pH大于0.1mol/L Na2SO3溶液的pH;
電離平衡常數:H2SO3Ki1=1.54×10-2 Ki2=1.02×10-7,H2CO3Ki1=4.3×10-7Ki2=5.6×10-11,酸的電離平衡常數大小順序是:H2SO3>HSO3->H2CO3>HCO3-,則酸根離子水解程度大小順序是CO32->HCO3->SO32->HSO3-,這些弱酸根離子都水解但程度都較小,所以SO32-、CO32-、HSO3-、HCO3-濃度從大到小的順序為c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-),
故答案為:大于;c(SO32-)>c(CO32-)>c(HCO3-)>c(HSO3-).
點評 本題考查了離子濃度大小比較,題目難度中等,明確鹽的水解原理及其影響為解答關鍵,注意掌握電荷守恒、物料守恒及鹽的水解原理在判斷離子濃度大小中的應用方法.


 習題精選系列答案
習題精選系列答案科目:高中化學 來源: 題型:選擇題
| A. | 晶體中不一定存在分子間作用力,但一定存在化學鍵 | |
| B. | 液態氟化氫中存在氫鍵,所以其沸點比氯化氫更高 | |
| C. | 向Fe(NO3)2溶液中通入過量的HI,最終Fe2+全部氧化成Fe3+ | |
| D. | 普通玻璃是將石灰石、石英、黏土在玻璃熔爐中高溫熔融制得的 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 化學反應中的能量變化都表現為熱量的變化 | |
| B. | 生成物總能量一定低于反應物總能量 | |
| C. | 放熱反應的反應速率總是大于吸熱反應的反應速率 | |
| D. | 同溫同壓下,H2(g)+Cl2(g)=2HCl(g)在光照和點燃條件下的△H相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬腐蝕就是金屬原子失去電子被還原的過程 | |
| B. | 鋼鐵吸氧腐蝕時,負極的電極反應式為:2H2O+O2+4e-═4OH- | |
| C. | 在鐵上鍍鋅時,應讓鋅作陰極,鐵作陽極 | |
| D. | 鋁制品不需要特殊的防腐措施原因是鋁易于被氧氣氧化形成致密的氧化物保護膜 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
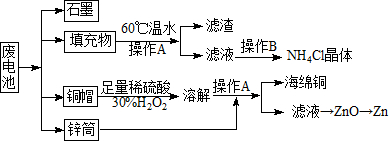 常見鋅錳干電池因含有汞、酸或堿等,廢棄后進入環境將造成嚴重危害.某化學興趣小組擬采用如下處理方法回收廢電池中的各種資源
常見鋅錳干電池因含有汞、酸或堿等,廢棄后進入環境將造成嚴重危害.某化學興趣小組擬采用如下處理方法回收廢電池中的各種資源查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | 用大理石鹽酸反應制取CO2 氣體,立即通入一定濃度Na2SiO3 溶液中 | 出現白色沉淀 | H2CO3酸性比H2SiO3酸性強 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中一種幾種 |
| C | 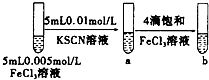 | 試管b比試管a中溶液紅色深 | 增大反應物濃度,平衡向正反應方向移動 |
| D | 等體積PH=3的HA和HB兩種酸分別與足量的鋅反應,排水法收集氣體 | HA放出的氫氣多且反應速率快 | HA酸性比HB強 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 剩余NO | B. | 剩余O2 | C. | 剩余NO2 | D. | 不剩余氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com