
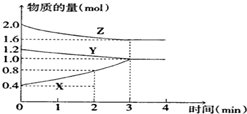
 某溫度時,在容積為2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示,由圖中數據分析:
某溫度時,在容積為2L的密閉容器中,X、Y、Z三種物質的物質的量隨時間變化的曲線如圖所示,由圖中數據分析:分析 (1)隨著反應的進行,Y、Z的物質的量減少而X的物質的量增多,說明Y、Z是反應物而X是生成物,3min時反應達到平衡狀態,參加反應的n(Y)=(1.2-1.0)mol=0.2mol、n(Z)=(2.0-1.6)mol=0.4mol、n(X)=(1.0-0.4)mol=0.6mol,同一可逆反應中同一時間段內參加反應的各物質的物質的量之比等于其計量數之比,據此確定方程式;
(2)反應開始至2min末,X的反應速率=$\frac{\frac{△n}{V}}{△t}$;
(3)根據圖知,0min時反應物和生成物都含有,所以正逆反應都有;
(4)增加固體或純液體不改變平衡移動;
(5)可逆反應達到平衡狀態時,正逆反應速率相等,反應體系中各物質的物質的量不變、物質的量濃度不變、百分含量不變以及由此引起的一系列物理量不變.
解答 解:(1)隨著反應的進行,Y、Z的物質的量減少而X的物質的量增多,說明Y、Z是反應物而X是生成物,3min時反應達到平衡狀態,參加反應的n(Y)=(1.2-1.0)mol=0.2mol、n(Z)=(2.0-1.6)mol=0.4mol、n(X)=(1.0-0.4)mol=0.6mol,同一可逆反應中同一時間段內參加反應的各物質的物質的量之比等于其計量數之比,所以Y、Z、X的計量數之比=0.2mol:0.4mol:0.6mol=1:2:3,所以該反應方程式為Y+2Z?3X,
故答案為:Y+2Z?3X;
(2)反應開始至2min末,X的反應速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.8-0.4)mol}{2L}}{2min}$=0.1 mol/(L•min),
故答案為:0.1 mol/(L•min);
(3)根據圖知,0min時反應物和生成物都含有,所以正逆反應都有,故答案為:正逆反應同時;
(4)增加固體或純液體不改變平衡移動,加入Y物質平衡不移動,說明Y為固體或純液體,故答案為:固體或純液;
(5)①反應前后氣體的物質的量不變,所以壓強始終不變,當混合氣體的壓強不變時不能判斷平衡狀態,故錯誤;
②反應前后氣體的質量增加但容器體積不變,所以反應前后氣體的密度增大,當混合氣體的密度不變時該反應達到平衡狀態,故正確;
③反應前后氣體的物質的量不變,所以混合氣體的體積始終不變,所以不能判斷平衡狀態,故錯誤;
④反應前后氣體的總物質的量不變,所以不能判斷平衡狀態,故錯誤;
故選②.
點評 本題考查化學平衡計算及化學平衡狀態判斷,為高頻考點,側重考查學生分析判斷計算能力,注意:固體和純液體沒有濃度,其量的多少不影響平衡移動,注意(5)為易錯點.


 出彩同步大試卷系列答案
出彩同步大試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 溴乙烷和乙酸乙酯 | B. | 乙醇和乙酸 | ||
| C. | 乙醇和乙酸乙酯 | D. | 苯乙烯和氯甲烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
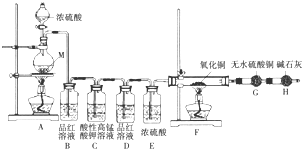
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
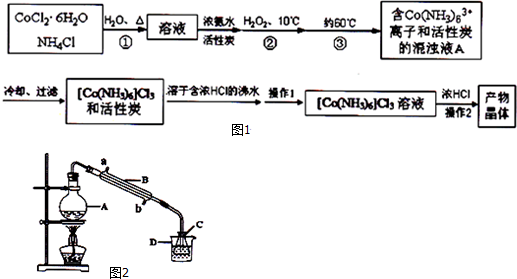
| 溫度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
| 指示劑 | 顏色 | 變色的pH范圍 | ||
| 甲基紅 | 紅 | 橙 | 黃 | 4.4~6.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
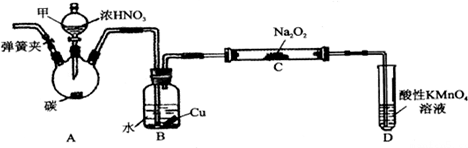
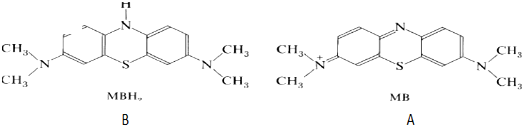
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
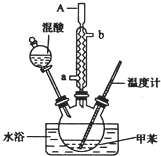 一硝基甲苯是一種重要的工業原料,某化學學習小組設計如圖所示裝置制備一硝基甲苯(包括對硝基甲苯和鄰硝基甲苯).反應原理:
一硝基甲苯是一種重要的工業原料,某化學學習小組設計如圖所示裝置制備一硝基甲苯(包括對硝基甲苯和鄰硝基甲苯).反應原理:
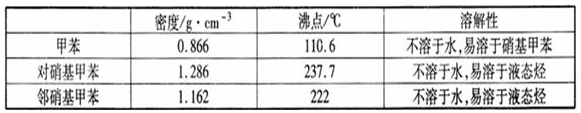
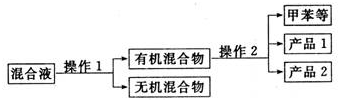
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等質量的硫蒸氣和硫固體分別在氧氣中完全燃燒,后者放出的熱量多 | |
| B. | 熱化學方程式C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(g)△H=-1256 kJ•mol-1,可知乙炔的燃燒熱為1256 kJ•mol-1 | |
| C. | 在101 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式為2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| D. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若將含0.5 molH2SO4的濃溶液與含1 mol NaOH的溶液混合,放出的熱量大于57.3 kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com