
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
分析 (1)根據化學反應方程式和化學平衡常數的概念書寫K的表達式,注意C為固體;
(2)溫度升高,化學平衡常數增大,說明平衡正向移動;
(3)達到化學平衡狀態,各組分濃度不變,正逆反應相等;
(4)平衡濃度符合c(CO)•c(H2)=c(H2O),可知K=1;
(5)為了提高H2O(g)的轉化率,可使平衡正向移動,結合溫度、壓強對平衡移動的影響判斷.
解答 解:(1)C為固體,則K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$,故答案為:$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;
(2)由于溫度升高,該反應的化學平衡常數減小,平衡向著逆向移動,正向反應是放熱反應,則逆反應為吸熱反應,故答案為:吸熱;
(3)A.反應前后氣體的體積不等,則容器內壓強不變,可說明達到平衡狀態,故A不選;
B.混合氣體中c(CO)不變,說明達到平衡狀態,故B不選;
C.v正(H2)=v逆(H2O),說明正逆反應速率相等,說明達到平衡狀態,故C不選;
D.無論是否達到平衡狀態,都滿足c(H2)=c(CO),故D選.
故答案為:D;
(4)平衡濃度符合c(CO)•c(H2)=c(H2O),可知K=1,則溫度為830℃,故答案為:830;
(5)為了提高H2O(g)的轉化率,可使平衡正向移動,可減小壓強,應正反應為放熱反應,則還可降低溫度,故答案為:減小壓強,降低溫度.
點評 本題主要考查溫度對化學平衡、化學平衡常數的影響,為高頻考點,難度不大,題目側重考查學生分析和解決問題的能力.


 教學練新同步練習系列答案
教學練新同步練習系列答案 課前課后同步練習系列答案
課前課后同步練習系列答案 課堂小作業系列答案
課堂小作業系列答案 黃岡小狀元口算速算練習冊系列答案
黃岡小狀元口算速算練習冊系列答案科目:高中化學 來源: 題型:解答題
 病人輸液用的葡萄糖注射液是葡萄糖(化學式為C6H12O6)的水溶液,其標簽上的部分內容如圖所示.利用標簽所提供的信息,回答下列問題:
病人輸液用的葡萄糖注射液是葡萄糖(化學式為C6H12O6)的水溶液,其標簽上的部分內容如圖所示.利用標簽所提供的信息,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
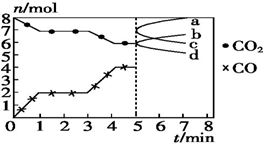 煉鐵的還原劑CO是由焦炭和CO2反應而得.現將焦炭和CO2放入體積為2L的密閉容器中,高溫下進行下列反應:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如圖為CO2、CO的物質的量n隨時間t的變化關系圖.下列說法正確的是( )
煉鐵的還原劑CO是由焦炭和CO2反應而得.現將焦炭和CO2放入體積為2L的密閉容器中,高溫下進行下列反應:C(s)+CO2(g)═2CO(g)△H=Q kJ•mol-1.如圖為CO2、CO的物質的量n隨時間t的變化關系圖.下列說法正確的是( )| A. | 0~1 min,v(CO)=1 mol•L-1•min-1;1~3 min,v(CO)=v(CO2) | |
| B. | 當容器內的壓強不變時,反應一定達到平衡狀態,$\frac{P(平衡)}{P(起始)}$<1 | |
| C. | 3 min時,溫度由T1升高到T2,則Q>0,再達平衡時,$\frac{K({T}_{2})}{K({T}_{1})}$>1 | |
| D. | 5 min時再充入一定量的CO,a、b曲線分別表示n(CO)、n(CO2)的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 碳及其化合物在科技、社會生產、生活中有著廣泛的應用.請按要求回答下列問題:
碳及其化合物在科技、社會生產、生活中有著廣泛的應用.請按要求回答下列問題:| 溫度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常數K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 | 濃度(mol/L) | 時間(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 溫 度 | 800℃ | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe比Cu的金屬性強,因此可用FeCl3腐蝕Cu刻制應刷電路板 | |
| B. | 純堿、小蘇打、鹽酸分別屬于堿、鹽、混合物 | |
| C. | 膠體化學是制造納米材料的有效方法之一 | |
| D. | 用萃取方法分離碘的苯溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 磁性氧化鐵溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向Na2SiO3溶液中通入過量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| C. | NaHSO4溶液與Ba(OH)2溶液反應,當SO42-完全沉淀時:H++SO42-+OH-+Ba2+═BaSO4↓+H2O | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com