
 2C,在反應過程中C的物質的量分數隨溫度變化如圖所示:
2C,在反應過程中C的物質的量分數隨溫度變化如圖所示:
 2C
2C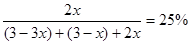 ;
;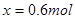


科目:高中化學 來源:不詳 題型:單選題
| A.②④ | B.③④ | C.①② | D.②③ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.NaOH固體 | B.CH3COONa固體 | C.NaCl晶體 | D.Na2CO3固體 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| 實驗 混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1H2SO4 / mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 飽和CuSO4溶液 / mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O / mL | V7 | V8 | V9 | 15 | 10 | 0 |
| 組別 | c(HA)/mo1·L-1 | c(NaOH)/mo1·L-1 | 混合液pH |
| 甲 | c | 0.2 | pH = 7 |
| 乙 | 0.2 | 0.1 | pH>7 |
| 丙 | 0.1 | 0.1 | pH = 9 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題
 2NH3(g);在2 min時達到平衡狀態,此時c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。
2NH3(g);在2 min時達到平衡狀態,此時c(N2)=5.00 mol·L-1,c(H2)=10.00 mol·L-1,c(NH3)=5.00 mol·L-1。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 4NO(g) + 6H2O(g) 在5L密閉容器中進行,半分鐘后,NO的物質的量增加了0.3mol,則此反應的平均速率x
4NO(g) + 6H2O(g) 在5L密閉容器中進行,半分鐘后,NO的物質的量增加了0.3mol,則此反應的平均速率x . (NH3) =" 0.008mol·(L·s)" –1
. (NH3) =" 0.008mol·(L·s)" –1查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 4C(g)+5D(g)在2L的密閉容器中進行,1min后A氣體減少了0.12mol,則平均每秒中濃度變化正確的是
4C(g)+5D(g)在2L的密閉容器中進行,1min后A氣體減少了0.12mol,則平均每秒中濃度變化正確的是| A.A氣體:0.05mol·L-1·min-1 | B. B氣體:0.075mol·L-1·min-1 |
| C.C氣體:0.04mol·L-1·min-1 | D.D氣體:0.075mol·L-1·min-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com