
分析 (1)亞鐵離子轉化為鐵離子被氧化,要加氧化劑,根據(jù)物質的性質及是否引進雜質確定選項;
(2)根據(jù)合金的定義、化合價的升降、發(fā)生反應的物質與轉移電子之間的關系判斷;
(3)根據(jù)得失電子數(shù)相等配平反應方程式,注意化合價的判斷方法;
(4)利用離子的水解產(chǎn)物的性質來分析凈水原因.
解答 解:(1)要使產(chǎn)物純凈,必須物質間發(fā)生反應后,沒有雜質生成.
a、氯氣有氧化性,能氧化二價鐵離子生成三價鐵離子,但同時有氯離子生成,所以有雜質生成,故a錯誤;
b、鐵與稀硫酸反應生成二價鐵離子,不能把二價鐵離子轉化為三價鐵離子,故b錯誤;
c、硝酸能氧化二價鐵離子生成三價鐵離子,但溶液中還有雜質硝酸根離子,故c錯誤;
d、雙氧水能氧化二價鐵離子生成三價鐵離子,同時有水生成,水是原溶液的成分,所以不是雜質,故d正確;
故答案為:d;
(2)a、合金是由兩種或兩種以上的金屬與非金屬經(jīng)一定方法所合成的具有金屬特性的物質,所以黃銅礦不是合金,故a錯誤;
b、CuFeS2中鐵元素的化合價為+2價,反應物Fe3+的化合價為+3價,生成物中Fe2+的化合價為+2價,所以不是所有鐵元素均被還原,故b錯誤;
c、CuFeS2中只有S元素的化合價只有升高,其他元素的化合價不變,所以CuFeS2只作還原劑,故c錯誤;
d、CuFeS2+4Fe3+=Cu2++5Fe2++2S 轉移電子4
184g 4mol
46g 1mol
故d正確;
故答案為:d;
(3)FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑,該反應,F(xiàn)eSO4中Fe的化合價為+2價,K2FeO4中Fe的化合價為+6價,所以一個氯化亞鐵分子失去4個電子;K2O2中O的化合價為-1價,O2中O的化合價為0價,一個K2O2分子失去2個電子生成氧氣;K2O2中O的化合價為-1價,K2FeO4和K2O中O元素的化合價為-2價,所以一個K2O2失去2個電子,該方程式中得失電子的最小公倍數(shù)為6,所以該方程式的計量數(shù)分別為2、6、2、2、2、1,即方程式為2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+1O2↑,
故答案為:2、6、2、2、2、1;
(4)高鐵酸鉀( K2FeO4)中Fe的化合價是+6價,具有強氧化性,能殺菌消毒,其還原產(chǎn)物Fe3+水解生成氫氧化鐵膠體,能吸附水中雜質,所以高鐵酸鉀作為水處理劑發(fā)揮的作用是凈水、消毒,
故答案為:凈水、消毒.
點評 本題考查了氧化還原反應,題目涉及鐵鹽和亞鐵鹽的相互轉化、離子檢驗等,難度不大,注意二價鐵離子和三價鐵離子的檢驗是高考的熱點,三價鐵離子能使KSCN變紅色


科目:高中化學 來源: 題型:解答題
| 陽離子 | Na+、Ba2+、NH4+ |
| 陰離子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
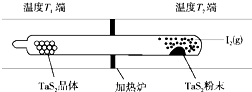 化學反應原理在科研和生產(chǎn)中有廣泛應用.
化學反應原理在科研和生產(chǎn)中有廣泛應用.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 弱酸化學式 | HClO | H2CO3 |
| 電離平衡常數(shù) | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④⑤ | B. | ②⑤⑥ | C. | ③④⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| X | Y | Z | |
| W |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 )常用于調制具有草莓、葡萄、櫻桃、香子蘭等香味的食用香精.
)常用于調制具有草莓、葡萄、櫻桃、香子蘭等香味的食用香精.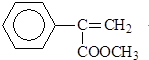 .
.
 .
.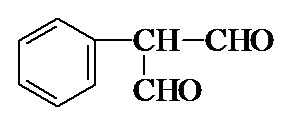 .
.查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com