
【題目】已知某溫度下CH3COOH的電離常數K=1.6×10-5,該溫度下向20 mL 0.01 mol·L-1CH3COOH溶液中逐滴加入0.01 mol·L-1KOH溶液,其pH變化曲線如圖所示(忽略溫度變化),請回答有關問題:
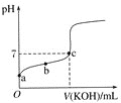
(1)a點溶液中c(H+)為____mol·L-1。
(2)b點溶液中溶質__,CH3COOH的電離常數___1.6×10-5(“>”、“<”或“=”)。
科目:高中化學 來源: 題型:
【題目】120℃、101.3 kPa,甲烷(CH4)和過量的O2的混合物,用電火花引燃(CH4+2O2=CO2+2H2O)后,恢復到原來的溫度和壓強,測得反應后氣體密度為相同條件下H2密度的15倍,則原混合氣體中甲烷和氧氣的體積比為( )
A. 2∶1B. 1∶2C. 1∶7D. 7∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2 L容器中三種物質的物質的量隨時間的變化曲線如圖所示。由圖中數據分析,該反應的化學方程式和反應開始至2 min末Z的平均反應速率分別為( )
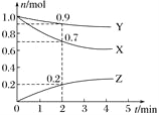
A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為2 L的密閉容器中進行如下反應:A(g)+2B(g)![]() 3C(g)+nD(g),開始時A為4 mol,B為6 mol;5 min后達到化學平衡,此時C的物質的量為3 mol,用D表示的化學反應速率v(D)為0.2 mol·L-1 min-1。
3C(g)+nD(g),開始時A為4 mol,B為6 mol;5 min后達到化學平衡,此時C的物質的量為3 mol,用D表示的化學反應速率v(D)為0.2 mol·L-1 min-1。
(1)5 min末B的物質的量濃度為________。
(2)前5 min內化學反應速率v(A)為_______。
(3)化學方程式中n值為________。
(4)該反應在此溫度下的平衡常數K=______(填數值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有反應:mA(g)+nB(g)![]() pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數減小,則:
(1)該反應的逆反應為__(填“吸熱”或“放熱”)反應,且m+n_(填“>”“=”或“<”)p。
(2)減壓使容器體積增大時,A的質量分數__。(填“增大”“減小”或“不變”,下同)
(3)若升高溫度,則平衡時B、C的濃度之比![]() 將___。
將___。
(4)若加入催化劑,平衡時氣體混合物的總物質的量____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X為一種常見酸的濃溶液,能使蔗糖粉末變黑。A與X反應的轉化關系如下圖所示,其中反應條件及部分產物均已略去,則下列有關說法正確的是( )
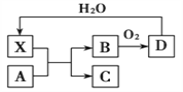
A. X使蔗糖變黑的現象主要體現了X的強氧化性
B. 若A為鐵,則足量A與X在室溫下即可完全反應
C. 若A為碳單質,則將C通入少量的澄清石灰水,一定可以觀察到白色沉淀產生
D. 工業上,B轉化為D的反應條件為高溫、常壓、使用催化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常用水鈷礦(主要成分為Co2O3,還含少量Fe2O3、Al2O3、MgO、CaO等雜質)制備鈷的氧化物,其制備工藝流程如下(已知Na2SO3能還原Fe3+和Co3+):

回答下列問題:
(1)在加入鹽酸進行“酸浸”時,能提高“酸浸”速率的方法有______________(任寫2種)。
(2)“酸浸”后加入Na2SO3鈷的存在形式為Co2+,產生Co2+反應的離子方程式為________
(3)溶液a中加入NaClO的作用是___________________________________
(4)沉淀a的成分是__________(寫化學式),操作2的名稱是_______________
(5)溶液d中的金屬離子只有Co2+和Na+兩種,則溶液c中加入NaF溶液的作用是________
(6)在空氣中緞燒CoC2O4生成鈷的某種氧化物和CO2,測得充分煅燒后固體質量為12.05g,CO2的體積為6.72L(標準狀況),則此反應的化學方程式為____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C是與生命活動密切相關的三種常見化合物,每種物質所含元素種類均不超過三種,甲是單質。它們之間有如下轉化關系:
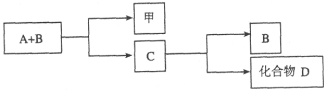
化合物D也是生活中常見的化合物,在一定條件下可發生如下反應:D+3甲![]() 3A+2B
3A+2B
請回答下列問題:
(1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。
(2)在常溫下,A和B通過__________轉化為C。該過程的能量轉化關系如何?
____________________。
(3)寫出由C生成D的反應的化學方程式____________________。
(4)化合物C是人類生命活動不可缺少的物質之一,它在血液中的正常含量是__________。
(5)目前化合物B在大氣中含量呈上升趨勢,對環境造成的影響是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、現有下列儀器或用品:①鐵架臺(含鐵圈、各種鐵夾);②錐形瓶;③滴定管(酸式與堿式);④燒杯(若干個);⑤玻璃棒;⑥天平(含砝碼);⑦濾紙;⑧量筒;⑨漏斗;⑩膠頭滴管。有下列藥品:①NaOH固體;②0.1000mol/L的標準NaOH溶液;③未知濃度的鹽酸;④Na2CO3溶液;⑤蒸餾水。試回答以下問題。
(1)做酸堿中和滴定時,還缺少的試劑是____;
(2)配制250mL0.1000mol/LNaOH溶液時,還缺少的儀器是____;
(3)過濾時,應選用上述玻璃儀器中的____(填編號)。
Ⅱ、為測定某H2C2O4溶液的濃度,取25.00mL該溶液于錐形瓶中,加入適量稀H2SO4后,用濃度為c mol/L KMnO4標準溶液滴定。滴定原理為:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定時,KMnO4溶液應裝在___(填“酸式或堿式滴定管”)中,達到滴定終點的現象為____。
(2)若滴定時,沒用標準液洗滌滴定管,會使得草酸溶液的物質的量濃度___(填“偏高”“偏低”“無影響”)
(3)若滴定時,反應前后的兩次讀數分別為a和b,則實驗測得所配草酸溶液的物質的量濃度為__mol/L。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com