已知A為中學化學中的一種鹽,B、C為日常生活中常見的金屬.通常條件下D為無色無味氣體,無色氣體G遇空氣變紅棕色.已知用惰性電極電解A溶液一段時間后,產物只有C、D和E的稀溶液.各物質之間的轉化關系如圖(部分反應產物已略去).
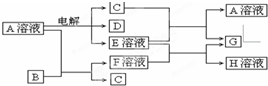
請回答下列問題:
(1)A的化學式為
.
(2)E的稀溶液與F溶液反應的離子方程式為
.
(3)電解100mL鹽A的溶液一段時間后,斷開電路,取出電極,測得生成的氣體D在標準狀況下的體積為5.6mL,則電解后溶液的pH為
.(假設溶液體積不變).
(4)若向100mL鹽A的溶液中加入10g金屬單質B的粉末,充分攪拌后,過濾,烘干得10.16g固體,則濾液中溶質的物質的量濃度為
.(假設溶液體積不變)
(5)在含C
2+的晶體中常含有雜質D
2+.在提純時為了除去D
2+,常加入合適氧化劑,使D
2+氧化為D
3+,下列物質可采用的是
.A.KMnO
4 B.H
2O
2 C.Cl
2 水 D.HNO
3然后再加入適當物質調整至溶液pH=4,使D
3+轉化為D(OH)
3,可以達到除去D
3+而不損失C
2+的目的.關于調整溶液pH,甲同學懷疑pH=4是否能達到除去D
3+而不損失C
2+的目的;乙同學認為可以通過計算確定,他查閱有關資料得到如下數據,常溫下D(OH)
3的溶度積K
sp=8.0×10
-38,C (OH)
2的溶度積K
sp=3.0×10
-20,設溶液中C
2+的濃度為3.0mol?L
-1,則C(OH)
2開始沉淀時溶液的pH為
,D
3+完全沉淀時溶液的pH為
,通過計算確定上述方案
(填“可行”或“不可行”,在溶液中當離子濃度小于1.0×10
-5 mol?L
-1可以認為沉淀完全).




 閱讀快車系列答案
閱讀快車系列答案