
【題目】堿式碳酸銅是一種用途廣泛的化工原料,實驗室以廢銅屑為原料制取堿式碳酸銅的步驟如下:
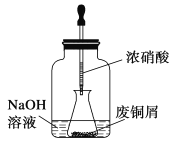
步驟一:廢銅屑制硝酸銅
如圖,用膠頭滴管吸取濃硝酸緩慢加到錐形瓶內的廢銅屑中(廢銅屑過量),充分反應后過濾,得到硝酸銅溶液。
步驟二:堿式碳酸銅的制備
向大試管中加入碳酸鈉溶液和硝酸銅溶液,水浴加熱至70 ℃左右,用0.4 mol·L-1的NaOH溶液調節pH至8.5,振蕩,靜置,過濾,用熱水洗滌,烘干,得到堿式碳酸銅產品。
完成下列填空:
(1)寫出濃硝酸與銅反應的離子方程式___________________________________________。
(2)上圖裝置中NaOH溶液的作用是_________________________。
(3)步驟二中,水浴加熱所需儀器有________、________(加熱、夾持儀器、石棉網除外),水浴加熱的優點是_______________________。
(4) 已知:CuCO3、Cu(OH)2受熱均易分解,產物中都有CuO生成。堿式碳酸銅可表示為xCuCO3·yCu(OH)2·zH2O(x、y、z取整數),測定堿式碳酸銅組成的方法有多種,現采用氫氣還原法,請回答如下問題:(已知M(Cu)=63.5 g·mol-1)。
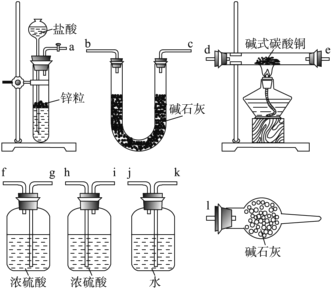
①寫出xCuCO3·yCu(OH)2·zH2O與氫氣反應的化學方程式:__________________;
②實驗裝置用上面所有儀器連接而成,按氫氣流方向的連接順序是(填入儀器接口字母編號):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )_____
③稱取23.9 g某堿式碳酸銅樣品,充分反應后得到12.7 g殘留物,生成4.4 g二氧化碳和7.2 g水。該樣品的結晶水質量為______ g,化學式為____________。
④某同學以氮氣代替氫氣,并用上述全部或部分儀器來測定堿式碳酸銅的組成,你認為是否可行?__________(填“可行”或“不可行”)請說明理由________________________。
【答案】 Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O 吸收氮氧化物 燒杯 溫度計 受熱均勻,便于控制溫度 xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O kj→gf(hi)→de(ed)→hi(gf)→bc(cb) 1.8 CuCO3Cu(OH)2H2O 可行 根據反應xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依據堿式碳酸銅、CuO、CO2和H2O質量(或其中任意三個量),即可計算出其組成。
===Cu2++2NO2↑+2H2O 吸收氮氧化物 燒杯 溫度計 受熱均勻,便于控制溫度 xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O kj→gf(hi)→de(ed)→hi(gf)→bc(cb) 1.8 CuCO3Cu(OH)2H2O 可行 根據反應xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依據堿式碳酸銅、CuO、CO2和H2O質量(或其中任意三個量),即可計算出其組成。
【解析】(1) 濃硝酸與銅反應生成硝酸銅、二氧化氮和水,離子方程式:Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O;正確答案:Cu+4H++2NO
===Cu2++2NO2↑+2H2O;正確答案:Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O。
===Cu2++2NO2↑+2H2O。
(2)由于反應產生的氮氧化物有毒,必須處理掉,用NaOH溶液吸收氮氧化物;正確答案:吸收氮氧化物。
(3)步驟二中,水浴加熱所需儀器有燒杯、溫度計;水浴加熱的優點是受熱均勻,便于控制溫度;正確答案:燒杯、溫度計;受熱均勻,便于控制溫度。
(4)①![]() 與氫氣反應生成單質銅、水、二氧化碳,反應式為:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O;正確答案:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O。
與氫氣反應生成單質銅、水、二氧化碳,反應式為:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O;正確答案:xCuCO3yCu(OH)2zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O。
②實驗中要測定生成的水、二氧化碳的量,從a口出來氣體中含有水蒸氣和揮發出來的氯化氫氣體,會對實驗造成干擾,應先用用水吸收氯化氫氣體,再用濃硫酸吸收水蒸氣;之后,與堿式碳酸銅發生反應,產生的兩種氣體先用濃硫酸吸收水蒸氣,再用U型管中的堿石灰吸收二氧化碳,同時連上裝有堿石灰的球形干燥管,避免空氣中的水和二氧化碳進入U型管而產生誤差,因此裝置的連接順序為a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l;正確答案:kj→gf(hi)→de(ed)→hi(gf)→bc(cb)。
③根據題中所給數據可計算出單質銅、水、二氧化碳的物質的量為0.2mol、0.4mol、0.1mol,因此可知![]() ,則x、y、z分別為1、1、1,該樣品的化學式為
,則x、y、z分別為1、1、1,該樣品的化學式為![]() ,結晶水的質量為
,結晶水的質量為![]() ;正確答案:1.8 ; CuCO3Cu(OH)2H2O。
;正確答案:1.8 ; CuCO3Cu(OH)2H2O。
④ 根據反應xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依據堿式碳酸銅、CuO、CO2和H2O質量(或其中任意三個量),即可計算出其組成,該方案可行;正確答案:可行;根據反應xCuCO3yCu(OH)2zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依據堿式碳酸銅、CuO、CO2和H2O質量(或其中任意三個量),即可計算出其組成。


科目:高中化學 來源: 題型:
【題目】化學與社會、生活密切相關,下列說法中錯誤的是
A.醫用酒精是利用了乙醇使蛋白質變性來殺菌消毒.
B.空氣質量日報中計入污染指數的項目為SO2、NOx、CO2
C.雙氧水、高錳酸鉀溶液消毒原理與漂白粉消毒飲用水的原理相同
D.鍋爐水垢中含有的CaSO4可先用飽和碳酸鈉溶液浸泡,然后用鹽酸除去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】紅磷(P)和白磷(P4)均為磷的同素異形體.已知:
P4(白磷、s)+5O2(g)═P4O10(s)△H═﹣2983.2kJ/mol
P(紅磷、s)+ ![]() O2(g)═
O2(g)═ ![]() P4O10(s)△H═﹣738.5kJ/mol
P4O10(s)△H═﹣738.5kJ/mol
寫出白磷轉化為紅磷的熱化學方程式 , 由此可知,紅磷比白磷 . (填“穩定”或“不穩定”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學家制得一種藍色鎢的氧化物(WOa),其中鎢的質量分數為0.7985.
(1)a=(保留2位小數).
(2)WOa中存在五價和六價兩種價態的鎢.則藍色鎢的氧化物中這兩種價態的鎢原子數之比為 . 將鐵錳的鎢酸鹽[(Fe,Mn)WO4]堿熔,發生如下反應(設空氣中N2、O2的體積分數分別為0,.8和0.2):4FeWO4+4Na2CO3+O2 ![]() 4Na2WO4+2Fe2O3+4CO2 ①
4Na2WO4+2Fe2O3+4CO2 ①
2MnWO4+2Na2CO3+O2 ![]() 2Na2WO4+2MnO2+2CO2 ②
2Na2WO4+2MnO2+2CO2 ②
(3)根據反應①,若反應前空氣為100L,反應后氣體為160L(氣體體積在同溫同壓下測定),則反應后所得氣體中CO2的體積分數為 .
(4)某工廠投料550mol Na2CO3制備Na2WO4 , 每反應1mol O2時,氣體就增加1.5mol,則生成物中Fe2O3與MnO2的物質的量之比為;若反應后氣體增加300mol,制得Na2WO4mol.
(5)由Na2WO4制備W的第一步反應為:Na2WO4+2HCl→H2WO4↓+2NaCl.往1L密度為1,.190g/cm3的37%的濃鹽酸加入6.030mol Na2WO4 , 恰好完全反應.將產生的沉淀過濾后,溶液中溶質只有NaCl,求該溶液中NaCl的質量分數(25℃時NaCl的溶解度為36.0g/100g水):
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列每組中各有三對混合物,它們都能用分液漏斗分離的是( )
A. 煤油和水,酒精和水,醋酸和水B. 植物油和水,四氯化碳和水,苯和水
C. 酒精和水,汽油和水,汽油和酒精D. 苯和水,四氯化碳和苯,醋酸和水
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】屠呦呦1971年發現、分離、提純并用于治瘧新藥“青蒿素”,救了數千萬人的生命,青蒿素分子結構如圖.下列有關說法正確的是( ) 
A.青蒿素可溶于乙醚和水
B.青蒿素的晶體為分子晶體,化學式為C16H20O5
C.青蒿素與NaOH溶液不反應
D.青蒿素含有過氧鍵,一定條件下有氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z均為短周期主族元素,已知它們的原子序數的關系為X+Z=2Y,且Z的最高價氧化物對應的水化物是強酸。則下列有關說法正確的是
A. 若X是Na,則Z的最高價一定為偶數
B. 若X是O,則YX一定是離子化合物
C. 若Y是O,則非金屬性Z>Y>X
D. 若Y是Na,則X、Z不可能是同一主族元素
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下能實現的是( ) ①NaAlO2(aq) ![]() AlCl3
AlCl3 ![]() Al
Al
②NH3 ![]() NO
NO ![]() HNO3
HNO3
③NaCl(飽和) ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
④FeS2 ![]() SO3
SO3 ![]() H2SO4 .
H2SO4 .
A.②③
B.①④
C.②④
D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“水煤氣(CO、H2)﹣空氣”燃料電池的工作原理如圖所示,其中a、b均
為惰性電極.下列敘述正確的是( )
A.甲處通入的是空氣,乙處通入的是水煤氣
B.a電極發生還原反應,b電極發生氧化反應
C.用該電池電鍍銅,若待鍍金屬增重6.4g,至少消耗標準狀況下的水煤氣2.24L
D.a電極的反應式包括:CO+4OH﹣+2e﹣═CO32﹣+2H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com