

分析 (1)依據燃燒熱的熱化學方程式結合蓋斯定律計算,寫出熱化學方程式;
(2)反應到達平衡狀態時,正逆反應速率相等,平衡時各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,由此進行判斷;
(3)①由圖可知,20min時到達平衡,氮氣的濃度變化量為(1-0.06)mol/L=0.04mol/L,再根據v=$\frac{△C}{△t}$計算v(N2);運用化學平衡常數計算表達式計算化學平衡常數;通入氦氣無法引起各組分濃度的變化進而無法影響平衡移動,化學平衡常數只受溫度的影響溫度不變平衡常數不變;
②與實驗Ⅰ相比,實驗Ⅱ反應速率加快,平衡氮氣濃度不變,不能是增大壓強或升高溫度,可能是加入催化劑;而實驗Ⅲ反應速率減慢,平衡時氮氣的濃度增大,正反應為體積減小的放熱反應,不能是減小壓強,可能是降低升高溫度;
(4)當N2和H2的物質的量之比為1:3時平衡時氨氣的百分含量最大,據此可以推算出M點的縱坐標的數值.
解答 解:(1)已知:①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用蓋斯定律將④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案為:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol;
(2)a.3v正(H2)=2v逆(NH3)說明正逆反應速率不相等,說明反應未達到平衡狀態,故a錯誤;
b.不論該可逆反應是否達到化學平衡狀態,用N2、H2、NH3的物質的量濃度變化表示化學反應速率的比一定為1:3:2,無法判斷是否達到化學平衡狀態,故b錯誤;
c.該容器的壓強保持不變,根據質量守恒定律知,反應前后混合氣體的質量不變,所以容器內氣體的密度變化,當容器中氣體的密度不再發生變化時,能表明達到化學平衡狀態,故c正確;
d.合成氨在恒壓密閉容器中進行,壓強始終不變,所以不能表達該反應已經達到平衡狀態,故d錯誤;
e.混合氣體平均相對分子質量=$\frac{總質量}{總物質的量}$,反應前后質量不變,若平均相對分子質量不變則氣體總物質的量可以說明反應已經達到平衡狀態,故e正確;
f.濃度之比不能判斷各組分的濃度是否變化,正逆反應速率是否相等,無法判斷是否達到了平衡狀態,故f錯誤;
故選ce;
(3))①由圖可知,20min時到達平衡,氮氣的濃度變化量為(1-0.06)mol/L=0.04mol/L,則v(N2)=$\frac{0.04mol/l}{20min}$=0.002mol/(L•min),故答案為:0.002mol/(L•min);化學平衡常數K=$\frac{{c}^{2}(NH3)}{c(N2){c}^{3}(H2)}$=$\frac{{0.08}^{2}}{{0.06×0.08}^{3}}$208.3,故答案為208.3;
②與實驗Ⅰ相比,實驗Ⅱ反應速率加快,平衡氮氣濃度不變,不能是增大壓強或升高溫度,可能是加入催化劑;而實驗Ⅲ反應速率減慢,平衡時氮氣的濃度增大,正反應為體積減小的放熱反應,不能是減小壓強,升高溫度反應速率加快,平衡逆向移動,可能是升高溫度,
故答案為:加入催化劑;升高溫度;
(4)當N2和H2的物質的量之比為1:3時平衡時氨氣的百分含量最大,所以橫坐標數值為3;
N2+3 H2=2NH3
起始:a 3a
△:b 3b 2b
平衡:a-b 3a-3b 2b
已知平衡時N2的體積分數為15.6%,則H2的體積分數為N2的3倍為46.8%,可以推得NH3的分數為1-15.6%-46.8%=37.6%,故答案為:3;37.6.
點評 本題考查了燃燒熱概念和熱化學方程式的書寫,化學反應速率和平衡常數的計算,化學平衡狀態的判斷,整體有一定的難度.


 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 煤的干餾、石油分餾、石油裂解都是化學反應 | |
| B. | 煤經過氣化、液化等化學變化可得到清潔燃料 | |
| C. | 人造纖維、合成纖維和油脂都是有機高分子化合物 | |
| D. | 棉花、羊毛、蠶絲、麻都由C、H、O元素構成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>X>Y | D. | Y>Z>X |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2 mol•L KNO3 | B. | 0.1 mol•L CuCl2 | ||
| C. | 0.2 mol•L Na2CO3 | D. | 0.2 mol•L(NH4)2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 已知反應2H2(g)+O2(g)═2H2O(g)的能量變化如圖所示,下列說法正確的是( )
已知反應2H2(g)+O2(g)═2H2O(g)的能量變化如圖所示,下列說法正確的是( )| A. | 2mol氫氣與1mol氧氣的總能量為1368kJ | |
| B. | 形成1molH-O鍵需要吸收463kJ的能量 | |
| C. | 氫氣與氧氣反應的熱化學方程式為2H2+O2═2H2O△H=-484kJ•mol-1 | |
| D. | 1mol氫氣與0.5mol氧氣反應生成1mol液態水放熱大于242kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
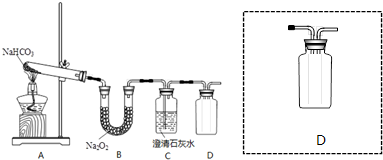
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
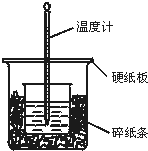 50mL 0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:
50mL 0.50mol/L鹽酸與50mL 0.55mol/L NaOH溶液在如圖所示的裝置中進行中和反應.通過測定反應過程中所放出的熱量可計算中和熱.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
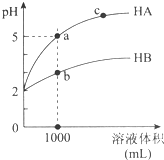 室溫下,pH均為2的兩種一元酸HA和HB各1mL,分別加水稀釋,pH隨溶液體積的變化曲線如圖所示.下列說法正確的是( )
室溫下,pH均為2的兩種一元酸HA和HB各1mL,分別加水稀釋,pH隨溶液體積的變化曲線如圖所示.下列說法正確的是( )| A. | HA的酸性比HB的酸性弱 | |
| B. | a點溶液的導電性比c點溶液的導電性弱 | |
| C. | 若兩溶液無限稀釋,則它們的c(H+)相等 | |
| D. | 對a、b兩點溶液同時升高溫度,則$\frac{c({A}^{-})}{{c(B}^{-})}$增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com