
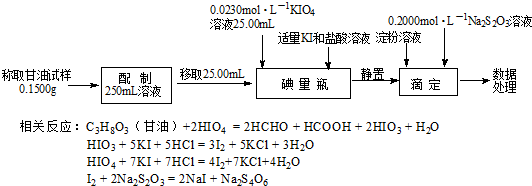
分析 Ⅰ.(1)根據電子得失守恒可知,將I2氧化為HIO4時,有關系式I2~7Cl2,根據碘的質量可計算出氯氣的量;
(2)根據碘元素守恒可知,1.270g I2氧化為高碘酸時,HIO4的物質的量為$\frac{1.270g}{254g/mol}$=0.005mol,同時生成氯化氫的物質的量為0.07mol,與氫氧化鉀反應的關系式為7HCl~HIO4~KOH,據此計算氫氧化鉀溶液的體積;
Ⅱ.(3)碘溶液中有淀粉,所以溶液呈藍色,用Na2S2O3標準溶液滴定達到滴定終點時溶液的藍色會褪去,據此判斷;
(4)根據題中的反應方程式可得關系式C3H8O3~$\frac{1}{2}$HIO3,I2~2Na2S2O3,3n(HIO3)+4n(HIO4)=n(I2),
碘量瓶中n(HIO3)+ n(HIO4)=n(KIO4)=0.0230 mol•L×25.00mL×10-3 L•mL=5.750×10-4 mol…①
滴定時:3n(HIO3)+4n(HIO4)=n(I2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.2000 mol•L×20.00mL×10-3 L•mL-1=2.000×10-3 mol…②
根據①②可求得與C3H8O3反應的HIO3,根據HIO3的物質的量可計算出甘油的質量,進而確定樣品的純度;
解答 解:Ⅰ.(1)根據電子得失守恒可知,將I2氧化為HIO4時,有關系式I2~7Cl2,1.270g 碘的質量為$\frac{1.270g}{254g/mol}$=0.005mol,所以消耗的氯氣的物質的量為0.035mol,其體積為0.035mol×22.4L/mol=0.784L,
故答案為:0.784;
(2)根據碘元素守恒可知,1.270g I2氧化為高碘酸時,HIO4的物質的量為$\frac{1.270g}{254g/mol}$×2=0.01mol,同時生成氯化氫的物質的量為0.07mol,與氫氧化鉀反應的關系式為7HCl~HIO4~KOH,所以氫氧化鉀溶液的體積為$\frac{0.01mol}{0.200mol•{L}^{-1}}$×8=0.05L×8=400mL,
故答案為:400;
Ⅱ.(3)碘溶液中有淀粉,所以溶液呈藍色,所以用Na2S2O3標準溶液滴定,判斷達到滴定終點的現象是滴入最后一滴標準液時,溶液藍色剛好褪去,且保持30秒不恢復原來的顏色,
故答案為:滴入最后一滴標準液時,溶液藍色剛好褪去,且保持30秒不恢復原來的顏色;
(4)根據題中的反應方程式可得關系式C3H8O3~$\frac{1}{2}$HIO3,I2~2Na2S2O3,3n(HIO3)+4n(HIO4)=n(I2),
碘量瓶中n(HIO3)+ n(HIO4)=n(KIO4)=0.0230 mol•L×25.00mL×10-3 L•mL=5.750×10-4 mol…①
滴定時:3n(HIO3)+4n(HIO4)=n(I2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.2000 mol•L×20.00mL×10-3 L•mL-1=2.000×10-3 mol…②
①×4-②得 n(HIO3)=3.000×10-4 mol
n(C3H8O3)=$\frac{1}{2}$n(HIO3)=1.500×10-4 mol
w(C3H8O3)=$\frac{1.5×1{0}^{-4}×92×10}{0.150}$×100%=92.00%,
答:甘油樣品的純度為92.00%.
點評 本題以高碘酸鉀的制備以及測定甘油的含量為載體,為高頻考點,側重于學生的分析能力、實驗能力和計算能力的考查,內容涉及方程式計算、氧化還原滴定、實驗基本操作等,難度中等,是對知識的綜合運用和能力的考查.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用氨水吸收足量的SO2氣體:2OH-+SO2═SO32-+H2O | |
| B. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| C. | 加入NaClO將污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| D. | NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等濃度時水溶液堿性:NaHCO3>Na2CO3 | |
| B. | 熱穩定性:NaHCO3>Na2CO3 | |
| C. | 與鹽酸溶液反應的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等質量的Na2CO3、NaHCO3分別與足量的鹽酸反應,NaHCO3產生的CO2多 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com