
【題目】Ⅰ.25℃時,部分物質的電離平衡常數如表所示:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11` | 3.0×10-8 |
請回答下列問題:
(1)列出CH3COONa的水解平衡常數Kh的計算式:_________。
(2)物質的量濃度相同的三種溶液:a.CH3COONa b.NaHCO3 c.NaClO
三種溶液的pH由小到大排列的順序是___<___< ____(用編號填寫)。
(3)寫出向NaClO溶液中通入少量CO2的化學方程式________。
Ⅱ.(4)碳酸鈉溶液呈堿性的原因是:_____________。(寫出離子方程式)。0.01mol/L Na2CO3溶液的pH___0.1mol/LNa2CO3溶液的pH。(填“>”或“<”或“=”)
(5)濃度均為0.1mol/L的①CH3COONa溶液②NH4Cl溶液③稀HCl④Na2SO4溶液按pH由大到小的排列順序為_______。
【答案】![]() a b c NaClO+CO2+H2O=NaHCO3+HClO CO32-+H2O
a b c NaClO+CO2+H2O=NaHCO3+HClO CO32-+H2O![]() HCO3-+OH < ①>④>②>③
HCO3-+OH < ①>④>②>③
【解析】
根據水解反應原理及平衡常數概念書寫水解平衡常數;根據電離平衡常數比較鹽溶液的酸堿性及pH大小;根據水解原理書寫相關水解方程式并比較溶液的pH。
Ⅰ.(1)CH3COONa水解的離子方程式為:CH3COO-+H2O![]()
![]() CH3COOH+OH-,則CH3COONa的水解平衡常數Kh的計算式為:
CH3COOH+OH-,則CH3COONa的水解平衡常數Kh的計算式為:![]() ;
;
(2)據電離平衡常數可知,酸性由強到弱的順序為:CH3COOH>H2CO3>HClO>HCO3,弱酸的酸性越弱其酸根離子的水解程度越大,溶液堿性越強,所以pH由小到大排列順序是CH3COONa<NaHCO3<NaClO,故答案為:a<b<c;
(3)根據電離平衡常數分析得:NaClO溶液中通入少量CO2反應生成次氯酸和碳酸氫鈉,反應方式為:NaClO+CO2+H2O=NaHCO3+HClO;
Ⅱ.(4)碳酸鈉屬于強堿弱酸鹽,發生水解反應使溶液呈堿性,離子方程式為:CO32-+H2O![]() HCO3-+OH-; Na2CO3溶液濃度越大,水解產生的OH-濃度越大,溶液堿性越強,pH越大,故0.01mol/L Na2CO3的pH<0.1mol/LNa2CO3溶液的pH,故答案為:CO32-+H2O
HCO3-+OH-; Na2CO3溶液濃度越大,水解產生的OH-濃度越大,溶液堿性越強,pH越大,故0.01mol/L Na2CO3的pH<0.1mol/LNa2CO3溶液的pH,故答案為:CO32-+H2O![]() HCO3-+OH;<;
HCO3-+OH;<;
(5)①CH3COONa溶液由于水解作用,溶液呈若堿性;②NH4Cl溶液由于水解作用,溶液呈若酸性;③稀HCl屬于強酸溶液,酸性較強;④Na2SO4溶液不水解,溶液呈中性,所以pH由大到小的排列順序為①>④>②>③,故答案為:①>④>②>③。


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】已知化學平衡、電離平衡、水解平衡和溶解平衡均符合勒夏特列原理。請回答下列問題:
(1)可逆反應FeO(s)+CO(g)![]() Fe(s)+CO2(g)是煉鐵工業中一個重要反應,其溫度與平衡常數K的關系如下表:
Fe(s)+CO2(g)是煉鐵工業中一個重要反應,其溫度與平衡常數K的關系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
若該反應在體積固定的密閉容器中進行,在一定條件下達到平衡狀態,若升高溫度,混合氣體的平均相對分子質量_____;充入氦氣,混合氣體的密度____(填“增大”“減小”或“不變”)。
(2)830℃,反應CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常數K=1,在2L恒容反應器中發生上述反應,分別充入3mol CO2,,2mol H2,1mol CH3OH,4mol H2O,反應向__方向進行。(填左/右)
CH3OH(g)+H2O(g)的平衡常數K=1,在2L恒容反應器中發生上述反應,分別充入3mol CO2,,2mol H2,1mol CH3OH,4mol H2O,反應向__方向進行。(填左/右)
(3)常溫下,濃度均為0.1 mol·L-1的下列六種溶液的pH如下表:
溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述鹽溶液中的陰離子,結合質子能力最強的是______。
②根據表中數據判斷,濃度均為0.01 mol·L-1的下列四種物質的溶液中,酸性最強的是____;將各溶液分別稀釋100倍,pH變化最小的是_____(填編號)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③據上表數據,請你判斷下列反應不能成立的是___(填編號)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3
④要增大氯水中HClO的濃度,可向氯水中加入少量的碳酸鈉溶液,反應的離子方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中學常見物質A、B、C、D、E、X,存在下圖轉化關系 (部分生成物和反應條件略去)。下列推斷不正確的是( )
![]()
A. 若D是一種強堿,則A、B、C均可與X反應生成D
B. 若D是一種強酸,則A既可以是單質,也可以是化合物,且D可與銅反應生成B或C
C. 若D為NaCl,且A可與C反應生成B,則E可能是CO2
D. 若D是一種白色沉淀,在空氣中最終變為紅褐色,則A可能是鐵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為提升電池循環效率和穩定性,科學家近期利用三維多孔海綿狀Zn(3DZn)可以高效沉積ZnO的特點,設計了采用強堿性電解質的3DZn—NiOOH二次電池,結構如下圖所示。電池反應為Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三維多孔海綿狀Zn具有較高的表面積,所沉積的ZnO分散度高
B. 充電時陽極反應為Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放電時負極反應為Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放電過程中OH通過隔膜從負極區移向正極區
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學技術大學的錢逸泰教授等以CCl4和金屬鈉為原料,在700℃時反應制造出納米級金剛石粉末和另一種化合物。該成果發表在世界權威的《科學》雜志上,被科學家們高度評價為“稻草變黃金”。下列有關說法中,你認為錯誤的是( )
A. Na的還原性強于金剛石B. 另一種化合物是NaCl
C. 納米級金剛石粉末可以透過半透膜D. 這個反應是置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將0.4gNaOH和1.069![]() 混合并配成溶液,向溶液中滴加0.1mol·
混合并配成溶液,向溶液中滴加0.1mol·![]() 稀鹽酸。下列圖像能正確表示加入鹽酸的體積和生成
稀鹽酸。下列圖像能正確表示加入鹽酸的體積和生成![]() 的物質的量的關系的是
的物質的量的關系的是
A.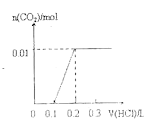 B.
B.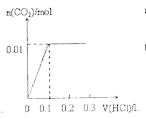
C.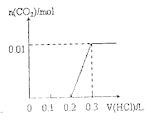 D.
D.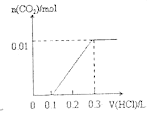
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 在101kPa時,1mol H2完全燃燒生成液態水,放出285.8kJ熱量,H2的燃燒熱為-285.8kJ·mol-1
B. 測定HCl和NaOH反應的中和熱時,每次實驗均應測量3個溫度,即鹽酸起始溫度,NaOH起始溫度和反應后終止溫度
C. 在101k Pa時,1mol C與適量O2反應生成1mol CO時,放出110.5kJ熱量,則C的燃燒熱為110.5kJ·mol-1
D. 在稀溶液中,H+(aq)+OH-(aq)=H2O(l),![]() H=-57.3 kJ·mol-1。若將含0.5mol H2SO4的濃硫酸與含1mol NaOH的溶液混合,放出的熱量等于57.3kJ
H=-57.3 kJ·mol-1。若將含0.5mol H2SO4的濃硫酸與含1mol NaOH的溶液混合,放出的熱量等于57.3kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.ClO2 是一種消毒、殺菌效率高、二次污染小的水處理劑。實驗室可通過以下反應制得 ClO2:2KClO3+H2C2O4+H2SO4 ═ 2ClO2↑+K2SO4+2CO2↑+2H2O,試回答下列問題。
(1)該反應中還原劑的化學式是 __________;被還原元素的元素符號是 _________ ;
(2)試比較 KClO3 和 CO2 的氧化性強弱 ____________________________________;
(3)消毒時,ClO2 還可以將水中的 Fe2+ 、 Mn2+ 等轉化成 Fe(OH)3 和MnO2 等難溶物,此過程說明 ClO2 具有 ___________ ( 填“氧化”或“還原” ) 性;
(4)當轉移 0.2mol 電子時,生成的ClO2在標準狀況下的體積為 ___________________。
Ⅱ.根據已學知識回答下列問題:
(1)在反應 KIO3 + 6HI==3I2 + KI + 3H2O中,氧化劑與還原劑的物質的量之比為________。
(2)2FeS+ 6H2SO4(濃)![]() Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反應中發生氧化反應和發生還原反應的硫元素物質的量之比為______
Fe2(SO4)3+ 3SO2+ 2S↓+ 6H2O中,反應中發生氧化反應和發生還原反應的硫元素物質的量之比為______
(3)配平下面兩個反應:
① ____H2O + ____Cl2 +____ SO2 ==____H2SO4 + ____HCl
② ____KMnO4 + ____HCl==____KCl + ____MnCl2 + ____Cl2↑ + ____H2O(系數是1的也請填上)
根據以上兩個反應反應,寫出由KMnO4、K2SO4 、MnSO4 、SO2、H2O、H2SO4 這六種物質組成的氧化還原反應的方程式并配平:______________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一種淡黃色粉末固體時,加熱有刺激性氣味的混合氣體放出,同時生成白色沉淀。當加入0.4mol淡黃色粉末時,產生氣體0.3mol,繼續加入淡黃色粉末時,產生無刺激性氣味的氣體,且加入淡黃色粉末時產生白色沉淀的量如下圖所示。
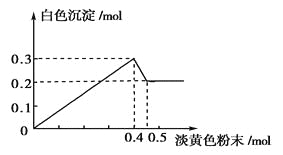
根據題意回答下列問題:
(1)淡黃色粉末為____________(填名稱)。
(2)溶液中肯定有______________離子,肯定沒有__________離子。
(3)溶液中各離子的物質的量之比為
________________________________________________________________________。
(4)寫出下列反應方程式:
①淡黃色粉末與水反應的化學方程式:____________________________________。
②刺激性氣味的氣體產生的離子方程式:______________________________________。
③沉淀部分減少時的離子方程式:_______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com