
【題目】可用如圖裝置制取、凈化、收集氣體的是
選項 | 氣體 | ① | ② | ③ |
|
A | NH3 | 濃氨水 | 生石灰 | 濃硫酸 | |
B | SO2 | 濃硫酸 | Na2SO3 | 濃硫酸 | |
C | NO2 | 濃硝酸 | 銅屑 | H2O | |
D | Cl2 | 濃鹽酸 | MnO2 | H2O |
A. A B. B C. C D. D
 優生樂園系列答案
優生樂園系列答案科目:高中化學 來源: 題型:
【題目】如圖所示裝置中,干燥燒瓶內盛有某種氣體,燒杯和滴管內盛放某種溶液。擠壓滴管的膠頭,然后打開止水夾,下列與實驗事實相符的是

A. NH3(H2O含紫色石蕊試液),紅色噴泉
B. SO2(NaOH溶液),無色噴泉
C. HCl(H2O含紫色石蕊試液),藍色噴泉
D. NO(NaOH溶液),無色噴泉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C三種元素,已知5.75 g A單質跟鹽酸完全反應,在標準狀況下產生2.8L氫氣和 0.25 mol ACln;B的氣態氫化物的分子式為 H2B,其相對分子質量與B的最高價氧化物的水化物相對分子質量之比為1: 2.88,B原子核內質子數與中子數相等;C和B可形成液態化合物 CB2,并能溶解B的單質。試回答下列問題:
(1)A、B、C的名稱分別是______、______、________;
(2) A離子的結構示意圖為_______; B在周期表中的位置為_______;CB2的分子式為_______。
(3)A與B形成的化合物的化學式為_________
(4)B的最高價氧化物的水化物的化學式為_________,
(5)寫出B的氣態氫化物與B的低價氧化物反應生成淡黃色固體的化學方程式:__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家預測原子序數為114的元素,具有相當穩定性的同位素,它的位置在第7周期IVA族,稱為類鉛。關于它的性質,預測錯誤的是
A.它的最外層電子數為4B.它的金屬性比鉛強
C.它具有+2、+3、+4價D.它的最高價氧化物的水化物是強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖虛線框中的裝置可用來檢驗濃硫酸與木炭粉在加熱條件下反應產生的所有氣體產物,填寫下列空白:
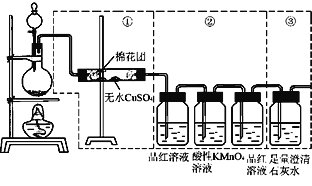
(1)濃硫酸與木炭粉在加熱條件下的化學方程式為________________。
(2)如果裝置中①、②、③三部分儀器的連接順序改為②、①、③,則可以檢驗出的物質是________________;不能檢出的物質是____________。
(3)如果將儀器的連接順序變為①、③、②,則可以檢出的物質是_____________;不能檢出的物質是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是( )
A. 人類歷史上使用最早的合金是青銅
B. 鋼屬于鐵合金
C. 目前世界上使用量最大的合金是鋁合金
D. 目前世界上用途最廣的是合金鋼
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是中學教材中元素周期表的一部分,其中標出A~Q14種元素,試回答下列問題:

(1)在上表所列出的短周期元素中
①性質最不活潑的是____________;②原子半徑最大的是(除稀有氣體元素)__________。
③形成的氣態氫化物最穩定的是______________________________;
④最高價氧化物對應的水化物中酸性最強的是____________堿性最強的是_____________。
⑤形成的陰離子還原性最弱的是_____________,陽離子半徑最小的是_____________。
(2)①B的氣態氫化物與最高價氧化物對應的水化物發生反應的化學方程式為________________;
②A單質與J的最高價氧化物對應的水化物反應的方程式________________________________。
(3)設P的原子序數為Z,則F的原子序數為______________,Q的原子序數為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.輝銅礦主要成分為Cu2S,軟錳礦主要成分為MnO2,它們都含有少量SiO2、Fe2O3等雜質。工業上綜合利用這兩種礦物制備硫酸錳和堿式碳酸銅的主要工藝流程如圖:

已知:①MnO2能將金屬硫化物中的硫氧化為單質硫;
②[Cu(NH3)4]SO4常溫穩定,在熱水中會分解生成NH3;
③部分金屬陽離子生成氫氧化物沉淀的pH范圍如下表所示(開始沉淀的pH按金屬離子濃度為1.0 mol·L-1計算):
開始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
(1)酸浸時,為了提高浸取率可采取的措施有________________(任寫一種)。
(2)調節浸出液pH的范圍為________,其目的是____________________。
(3)本工藝中可循環使用的物質是________(寫化學式)。
(4)在該工藝的“加熱驅氨”環節,若加熱的溫度較低或過高,都將造成__________的結果。
Ⅱ.海水開發利用的部分過程如下圖所示。

(1)海水中提取的NaCl中若混有少量的KClO3固體(KClO3溶解度隨溫度變化大),可通過______、________、_________的操作凈化。
(2)生成Mg(OH)2用的沉淀劑一般是生石灰或熟石灰,所以Mg(OH)2沉淀中會混有Ca(OH)2,可通過反復洗滌去除Ca(OH)2,檢驗沉淀是否洗凈的操作方法_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各數值表示元素原子序數,在各組中能以離子鍵相互結合成穩定化合物的是( )
A. 10和19 B. 6和16 C. 11和17 D. 14和8
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com