
【題目】乳酸亞鐵晶體([CH3CH(OH)COO]2Fe·3H2O,Mr=288)是常用的補鐵劑易溶于水,吸收效果比無機鐵好。乳酸亞鐵可由乳酸與FeCO3反應制得。
I.制備碳酸亞鐵(FeCO3)
已知FeCO3易被氧化:4FeCO3+6H2O+O2=4Fe(OH)3+4CO2。某興趣小組設計如下方案制備FeCO3,實驗裝置如圖:
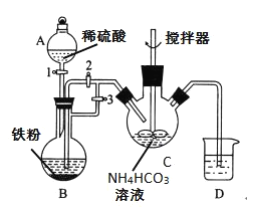
(1)儀器B的名稱是__。
(2)利用如圖所示裝置進行實驗,進行以下兩步操作:
第一步:打開活塞1、3,關閉活塞2,反應一段時間;
第二步:關閉活塞3,打開活塞2,發現C中有白色沉淀和氣體生成。
①第一步驟的目的是__。
②C中反應生成白色沉淀的離子方程式是:__。
③儀器C中的混合物經過濾,洗滌后得到FeCO3沉淀。實驗室中進行過濾后沉淀洗滌的操作是:__。
④裝置D中可盛裝適量的水,該裝置作用是__。
II.制備乳酸亞鐵晶體和定量測量
(1)制備乳酸亞鐵晶體。將制得的FeCO3加入到乳酸溶液中,加入少量鐵粉,在70℃下攪拌使反應充分進行,一段時間后,經過分離提純操作,從所得溶液中得到乳酸亞鐵晶體。現需要設計實驗檢測產品在制備過程是否因氧化而發生變質,可選用的試劑__。
(2)用碘量法測定晶體樣品中鐵元素的含量并計算樣品的純度。稱取3.00g晶體樣品,在足量空氣中灼燒成灰,加足量稀硫酸溶解,將所有可溶物配成l00mL溶液。取25.00mL該溶液加入過量的KI反應,加入幾滴__(試劑名稱)作指示劑,用0.l0mol/L的硫代硫酸鈉溶液滴定(I2+2S2O32-=S4O62-+2I-),重復實驗3次,滴定終點時平均消耗硫代硫酸鈉25.00mL,則樣品純度為__。
【答案】蒸餾燒瓶 產生氫氣將裝置內空氣排盡,防止二價鐵被氧化 Fe2++2HCO3-=FeCO3↓+CO2↑+H2O 用玻璃棒引流,向過濾器中注入蒸餾水至浸沒固體,讓水濾去,重復2至3次 形成液封,防止C中產品接觸空氣被氧化變質 KSCN溶液 淀粉溶液 96%
【解析】
I.制備碳酸亞鐵:由裝置可知,A中為鹽酸與鐵粉反應生成氯化亞鐵和氫氣的反應,Fe+2H+=Fe2++H2↑,實驗時,要先后打開活塞1和3一段時間,使反應發生,生成的氫氣趕走裝置中的空氣,防止生成的亞鐵離子被氧化,然后關閉活塞3,打開活塞2,生成的氫氣使A中氣壓增大,將生成的氯化亞鐵溶液壓入B中與碳酸銨發生反應生成碳酸亞鐵,發生Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,裝置D中加入水形成液封,使整個體系處于無氧環境。
I.(1)根據其結構可知為蒸餾燒瓶;
(2)①反應一段時間使裝置內充滿氫氣,排出空氣防止產品被氧化;
②氯化亞鐵溶液和碳酸氫銨反應生成碳酸鐵,離子方程式為Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
③洗滌沉淀的操作為用玻璃棒引流,向過濾器中注入蒸餾水至浸沒固體,讓水濾去,重復2至3次;
④碳酸亞鐵容易被氧化,整個過程需要在無氧環境進行,D中加入適量水可以形成液封,防止C中產品接觸空氣被氧化變質;
II.(1)變質后會有Fe3+生成,可用KSCN溶液進行檢驗;
(2)該滴定原理為:先將樣品在空氣中灼燒然后加稀硫酸溶解,此時鐵元素全部以Fe3+的形式存在,加過量KI與鐵離子反應2Fe3++2I-=I2+Fe2+,然后利用硫代硫酸鈉標準液滴定生成的碘單質的量從而確定鐵元素的量,淀粉遇碘變藍,所以可用淀粉溶液作指示劑,滴定終點碘單質被還原成碘離子,溶液變為無色;根據過程中的反應2Fe3++2I-=I2+Fe2+,I2+2S2O32-=S4O62-+2I-可知Fe3+~ S2O32-,且 n{[CH3CH(OH)COO]2Fe·3H2O}=n(Fe3+),所以樣品的純度為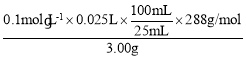 ×100%=96%。
×100%=96%。


科目:高中化學 來源: 題型:
【題目】某簡單離子的結構示意圖可表示為: 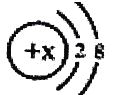 ,當x=8時,該粒子符號為________;當x=11時,該粒子符號為________;當x=13時,寫出該粒子的硝酸鹽的化學式為________.
,當x=8時,該粒子符號為________;當x=11時,該粒子符號為________;當x=13時,寫出該粒子的硝酸鹽的化學式為________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年諾貝爾化學獎授予研發鋰離子電池的三位科學家。磷酸亞鐵鋰(![]() )常用于生產鋰離子電池,請回答下列問題:
)常用于生產鋰離子電池,請回答下列問題:
(1)![]() 中Li元素的化合價為______。
中Li元素的化合價為______。
(2)某鋰離子電池放電時,![]() 以陽離子的形式脫離
以陽離子的形式脫離![]() 電極后,剩余的
電極后,剩余的![]() 本身會轉變為一種電中性化合物,該化合物的化學式為____,放電過程中
本身會轉變為一種電中性化合物,該化合物的化學式為____,放電過程中![]() ;發生了______(填“氧化”或“還原”)反應。
;發生了______(填“氧化”或“還原”)反應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰碘電池的正極材料是聚2-乙烯吡啶(簡寫為P2VP)和I2的復合物,電解質是熔融薄膜狀的碘化鋰,該電池發生的總反應為2Li+P2VP·nI2![]() P2VP·(n-1)I2+2LiI。下列說法正確的是 ( )
P2VP·(n-1)I2+2LiI。下列說法正確的是 ( )
A.該電池放電時,鋰電極發生還原反應
B.該電池放電時,碘離子移向正極
C.P2VP和I2的復合物是絕緣體,不能導電,充電時與外電源的負極相連
D.放電時正極的電極反應式為P2VP·nI2+2e-+2Li+=P2VP·(n-1)I2+2LiI
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在硝酸鋁和硝酸鎂的混合溶液中,逐滴加入稀氫氧化鈉溶液,直至過量。下列表示氫氧化鈉加入量(X)與溶液中沉淀物的量(Y)的關系示意圖中正確的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.2-丁烯不存在順反異構體
B.已知丙烷的二氯代物有四種異構體,則其六氯代物的異構體數目為六種
C.菲的結構簡式為 ,它與硝酸反應,可生成4種一硝基取代物
,它與硝酸反應,可生成4種一硝基取代物
D.乙醛的核磁共振氫譜中有二個峰,峰面積之比是1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向恒溫真空密閉容器中投入足量的FeC2O4(s),發生的反應為FeC2O4(s)![]() FeO(s)+CO(g)+ CO2(g) ΔH(制備FeO的原理),達到平衡時測得c(CO2)=c1 mol·L-1。溫度不變,壓縮容器體積至原來的一半,達到新平衡時測得c(CO2)=c2 mol·L-1。下列有關說法正確的是 ( )
FeO(s)+CO(g)+ CO2(g) ΔH(制備FeO的原理),達到平衡時測得c(CO2)=c1 mol·L-1。溫度不變,壓縮容器體積至原來的一半,達到新平衡時測得c(CO2)=c2 mol·L-1。下列有關說法正確的是 ( )
A.當混合氣體中CO的體積分數保持不變時達到平衡狀態
B.縮小容器體積,FeC2O4(s)、FeO(s)的物質的量保持不變
C.兩次平衡體系中c1=c2
D.若溫度不變,增大容器體積達到新平衡時,平衡常數減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼砂是含結晶水的四硼酸鈉,其陰離子Xm-(含B、O、H三種元素)的球棍模型如圖所示。下列說法正確的是( )
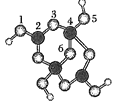
A.m=2
B.在Xm-中,硼原子軌道的雜化類型相同
C.1、2原子間和4、5原子間的化學鍵可能是配位鍵
D.若382g硼砂晶體中含2molNa+,則硼砂的化學式為Na2B4O710H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室可用濃鹽酸與濃硫酸混合快速制取HCl.下列解釋合理的是( )
A.濃硫酸是高沸點的酸,通過它與濃鹽酸反應制取低沸點的酸
B.通過改變溫度和濃度等條件,利用平衡移動原理制取HCl
C.兩種強酸混合,溶解度會相互影響,低溶解度的物質析出
D.濃硫酸的濃度遠大于濃鹽酸的濃度,高濃度的酸制取低濃度的酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com