
 A、B、C、D、E五種短周期元素(A、B、C、D、E分別代表元素符號),它們的原子序數依次增大;A是元素周期表中原子半徑最小的元素;B元素最高價氧化物對應的水化物與其氫化物反應生成一種鹽X;D與A同主族,且與E同周期;E元素原子的最外層電子數是其次外層電子數的$\frac{3}{4}$倍;C與E同主族.
A、B、C、D、E五種短周期元素(A、B、C、D、E分別代表元素符號),它們的原子序數依次增大;A是元素周期表中原子半徑最小的元素;B元素最高價氧化物對應的水化物與其氫化物反應生成一種鹽X;D與A同主族,且與E同周期;E元素原子的最外層電子數是其次外層電子數的$\frac{3}{4}$倍;C與E同主族.分析 A、B、C、D、E五種短周期元素,它們的原子序數依次增大,A是元素周期表中原子半徑最小的元素,則A為H元素;B元素最高價氧化物對應的水化物與其氫化物反應生成一種鹽X,則B為N元素,X為硝酸銨;D與A同主族,且與E同周期,所以D為Na,E為第三周期元素,E元素原子的最外層電子數是其次外層電子數的3/4倍,則最外層電子數為6,即E為S;C與E同主族,結合原子序數可知,C為O,然后結合元素及其單質、化合物的性質來解答.
解答 解:(1)由上述分析可知,X為NH4NO3,元素D與E形成的酸式鹽為NaHS,屬于離子化合物,NaHS的電子式為:Na+[:$\underset{\stackrel{••}{S}}{••}$:H]-,
故答案為:NH4NO3;Na+[:$\underset{\stackrel{••}{S}}{••}$:H]-;
(2)C為O,E為S,非金屬性C>E,可利用氣態氫化物的穩定性及單質之間的置換反應來說明,故②③能說明這一結論,故答案為:②③;
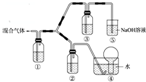
(3)a.BC為NO,BC2為NO2,濃硝酸能將氣體BC氧化成BC2,而稀硝酸不能氧化BC,則①中為水,②中為稀硝酸,③中為濃硝酸可驗證濃硝酸的氧化性比稀硝酸的氧化性強,生成的二氧化氮在⑤中與堿反應,故答案為:H2O;稀HNO3;
b.該實驗成功可觀察到裝置②中液面上方氣體仍為無色,裝置③中液面上方氣體由無色變為紅棕色,
故答案為:裝置②中液面上方氣體仍為無色,裝置③中液面上方氣體由無色變為紅棕色.
點評 本題考查位置、結構、性質的應用,為高考常見題型,側重于學生的分析、實驗能力的考查,注意元素的推斷是解答本題的關鍵,明確非金屬性的比較及硝酸的性質是解答本題的關鍵,(3)中實驗為解答的難點,把握NO易被氧化及有關的反應即可解答,題目難度較大.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | CaCl2═Ca2++Cl2 | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2OH- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 非金屬元素氮有多種氧化物,如NO、NO2、N2O4等.
非金屬元素氮有多種氧化物,如NO、NO2、N2O4等.| 時間(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 溫度/℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
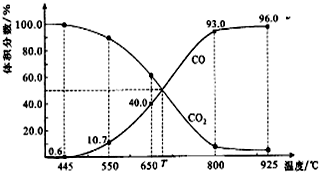
| A. | 550℃時,若充入惰性氣體,v正,v逆均減小,平衡不移動 | |
| B. | 650℃時,反應達平衡后CO2的轉化率為25.0% | |
| C. | T℃時,若充入等體積的CO2和CO,平衡向逆反應方向移動 | |
| D. | 該反應為吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 容器內氣體壓強保持不變 | |
| B. | 吸收ymolH2只需1 mo1MHx | |
| C. | 若向容器內通入少量氫氣,則V(放氫)>V(吸氫) | |
| D. | 若降溫,該反應的平衡常數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
| X | Y | ||
| Z | W | M |
 ;
; ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| B. | 無色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| D. | 通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com