
【題目】25℃時,電離平衡常數:
化學式 | CH3COOH | H2CO3 | HClO |
電離平衡常數 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)用蒸餾水稀釋0.10mol/L的醋酸,則下列各式表示的數值隨水量的增加而增大的是_____;
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)體積為10mLpH=2的醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程pH變化如圖,則HX的電離平衡常數______(填“大于”、“等于”或“小于”)醋酸的平衡常數,稀釋后,HX溶液中水電離出來的c(H+)_____醋酸溶液中水電離出來的c(H+)(填“大于”、“等于”或“小于”)。

【答案】B 大于 大于
【解析】
(1)醋酸的電離方程式為:CH3COOH![]() CH3COO-+H+,加水稀釋CH3COOH、CH3COO-、H+的濃度均減小。
CH3COO-+H+,加水稀釋CH3COOH、CH3COO-、H+的濃度均減小。
A.由Ka=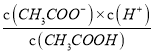 可知,溫度不變Ka不變,c(CH3COO-)減小,則
可知,溫度不變Ka不變,c(CH3COO-)減小,則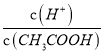 增大,
增大,![]() 減小,A錯誤;
減小,A錯誤;
B.由Ka=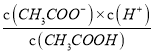 可知,溫度不變Ka不變,c(H+)減小,
可知,溫度不變Ka不變,c(H+)減小,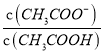 增大,B正確;
增大,B正確;
C.溫度不變KW不變,c(H+)減小,故![]() 減小,C錯誤;
減小,C錯誤;
D.KW=c(H+)×c(OH-),溫度不變KW不變,c(H+)減小,則c(OH-)增大,所以![]() 減小,D錯誤;
減小,D錯誤;
故答案選B。
(2)稀釋相同的倍數,pH變化大的電離程度大,由圖可知,HX的pH變化大,則HX的電離程度大,電離平衡常數大;由圖可知,稀釋后醋酸的酸性更強,酸性更強,則抑制水電離的程度更大,故醋酸中,水電離出來的c(H+)濃度更小,故答案為:大于;大于。


科目:高中化學 來源: 題型:
【題目】2019年3月,我國科學家研發出一種新型的鋅碘單液流電池,其原理如圖所示。下列說法不正確的是

A. 放電時B電極反應式為:I2+2e-=2I-
B. 放電時電解質儲罐中離子總濃度增大
C. M為陽離子交換膜,N為陰離子交換膜
D. 充電時,A極增重65g時,C區增加離子數為4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】前四周期元素 A、B、C、D、E 的原子序數依次增大,A 元素原子的核外電子只有一種運動狀 態;基態 B 原子 s 能級的電子總數比 p 能級的多 1;基態 C 原子和基態 E 原子中成對電子數均是未成對電 子數的 3 倍;D 形成簡單離子的半徑在同周期元素形成的簡單離子中最小。回答下列問題:
(1) E 的元素名稱為________。
(2)元素 A、B、C 中,電負性最大的是________(填元素符號,下同),元素 B、C、D 第一電離能由大到小的順序為________。
(3)與同族其它元素 X 形成的 XA3相比,BA3易液化的原因是________;BA3分子中鍵角________109°28'(填“>”“<”或“=”),請寫出與BA3互為等電子體的一個離子________。
(4)BC3 離子中 B 原子軌道的雜化類型為________,BC3 離子的立體構型為________。
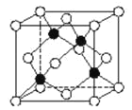
(5)化合物DB是人工合成的半導體材料,它的晶胞結構與金剛石(晶胞結構如圖 所示)相似。若 DB 的晶胞參數為 a pm,則晶體的密度為________g·cm3(用NA表示阿伏加德羅常數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某淡黃色固體A(僅含三種元素,式量小于160)可用于制藥,為探究其組成和性質,設計并完成如下實驗:
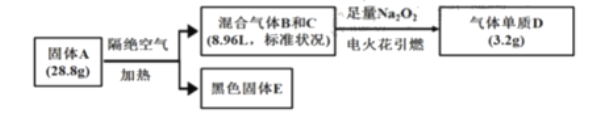
已知:①上述流程中所涉及的反應都充分進行。
②B、C、D均為常見氣體。相同情況下氣體B的密度大氣體C。
③黑色固體![]() 溶于鹽酸后滴加KSCN,無明顯現象,加適量氯水后,溶液變紅。
溶于鹽酸后滴加KSCN,無明顯現象,加適量氯水后,溶液變紅。
請問答:
(1)寫出氣體B的電子式__,固體A的化學式是__。
(2)黑色固體E與足量濃硝酸反應的離子反應方程式是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,將除去表面氧化膜的Al、Cu片插入濃HNO3中組成原電池(如圖1),測得原電池的電流強度(I)隨時間(t)的變化如圖2所示,已知0-t1時,原電池的負極是Al片,反應過程中有紅棕色氣體產生。下列說法不正確的是

A. 0-t1時,正極的電極反應式為:2H++ NO3- - e-=NO2+ H2O
B. 0-t1時,溶液中的H+ 向Cu電極移動
C. t1時,負極的電極反應式為:Cu–2e-= Cu2+
D. t1時,原電池中電子流動方向發生改變是因為Al在濃硝酸中鈍化,氧化膜阻礙了Al的進一步反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019 年“兩會”政府工作報告指出:開展藍天、碧水、凈土保衛戰。煤的綜合利用 可減少直接燃燒造成的污染。下列有關煤干餾的產品說法正確的是
A.![]() 和
和![]() 互為同系物
互為同系物
B.甲烷能被氧氣或酸性高錳酸鉀溶液氧化
C.CH2=CH2 水化制乙醇屬于取代反應
D.![]() 的一氯代物共有 3 種
的一氯代物共有 3 種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】自然界中含錳元素的主要礦物有軟錳礦(MnO2·xH2O)、黑錳礦Mn3O4,大洋底部有大量錳結核礦。錳元素在多個領域中均有重要應用,用于制合金,能改善鋼的抗沖擊性能等。
(1)Mn在元素周期表中位于___區,核外電子占據最高能層的符號是___,金屬錳可導電,導熱,具有金屬光澤,有延展性,這些性質都可以用“___理論”解釋。
(2)Mn3+在水溶液中容易歧化為MnO2和Mn2+,下列說法合理的是___。
A.Mn3+的價電子構型為3d4,不屬于較穩定的電子構型
B.根據Mn2+的電子構型可知,Mn2+中不含成對電子
C.第四周期元素中,錳原子價電子層中未成對電子數最多
D.Mn2+與Fe3+具有相同的價電子構型,所以它們的化學性質相似
(3)在K2MnF6中,MnF62-的空間構型是正八面體,則中心原子的價層電子對數為__。該化合物中含有的共價鍵在形成過程中原子軌道的重疊方式為__。
(4)二價錳的化合物MnO和MnS熔融態均能導電,熔點MnO___MnS(選填“高于”、“等于”、“低于”)并解釋原因___。
(5)某錳氧化物的晶胞結構如圖:
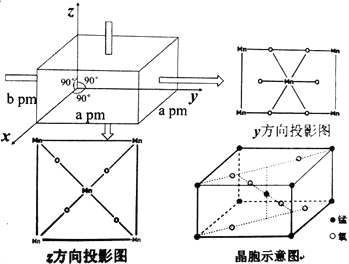
該錳的氧化物的化學式為___,該晶體中Mn的配位數為____,該晶體中Mn之間的最近距離為___pm(用a、b來表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值,下列說法錯誤的是( )
A.18g 氨基(-N2H2)中含有的電子數為 9 NA
B.32g Cu 在足量O2或硫蒸氣中完全反應失去的電子數均為NA
C.用惰性電極電解 100mL 0.1mol·L-1的 CuSO4 溶液,當陰、陽兩極產生相同條件下等體積的氣體時,電路中轉移電子數為 0.04 NA
D.等物質的量的FeBr2 和Cl2 在溶液中的反應 Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符合的是

A. 圖甲表示燃料燃燒反應的能量變化
B. 圖乙表示酶催化反應的反應速率隨反應溫度的變化
C. 圖丙表示可逆反應從加入反應物開始建立化學平衡的過程
D. 圖丁表示將NH3通入醋酸溶液的過程中,溶液導電性的變化
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com