
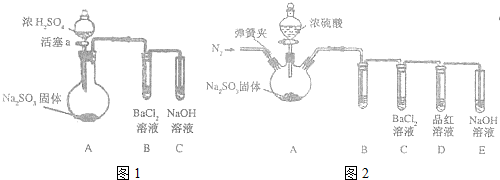
分析 (1)根據反應物、生成物和反應條件書寫化學方程式;
(2)①根據Na2SO3+SO2+H2O═2NaHSO3,NaOH+SO2═NaHSO3分析解答;
②NaOH溶液吸收了足量的SO2后生成NaHSO3,與一定量的石灰水溶液充分反應生成亞硫酸鈣、氫氧化鈉、水;
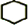
(3)②二氧化硫具有還原性易被氧氣氧化成三氧化硫,三氧化硫與水反應生成硫酸,與BaCl2溶液反應生成BaSO4沉淀;
③為證明SO2與BaCl2溶液不能得到BaSO3沉淀,可通入氮氣排出裝置中的氧氣.
解答 解:(1)根據題意,碳酸鈣與二氧化硫、氧氣在高溫條件下反應生成硫酸鈣,同時生成二氧化碳,所以反應的方程式為:2CaCO3+2SO2+O2$\frac{\underline{\;高溫\;}}{\;}$2CaSO4+2CO2,
故答案為:2CaCO3+2SO2+O2$\frac{\underline{\;高溫\;}}{\;}$2CaSO4+2CO2;
(2)①假設生成的NaHSO3物質的量都為2mol,Na2SO3+SO2+H2O═2NaHSO3,吸收的二氧化硫的物質的量為2mol,需1molNa2SO3,NaOH+SO2═NaHSO3,吸收的二氧化硫的物質的量也為2mol,需2molNaOH,假設Na2SO3溶液和NaOH溶液的物質的量濃度都為Cmol/L,兩種吸收液體積比V(Na2SO3):V(NaOH)=$\frac{1}{C}$:$\frac{2}{C}$=1:2,
故答案為:1:2;
②NaOH溶液吸收了足量的SO2發生反應:NaOH+SO2═NaHSO3,與一定量的石灰水溶液充分反應NaHSO3+Ca(OH)2=CaSO3↓+NaOH+H2O,離子反應為:Ca2++OH-+HSO3-=CaSO3↓+H2O,使NaOH溶液再生,
故答案為:Ca2++OH-+HSO3-=CaSO3↓+H2O;
(3)②二氧化硫具有還原性易被氧氣氧化成三氧化硫,與BaCl2溶液反應,三氧化硫與水反應生成硫酸,H2SO4+BaCl2=BaSO4↓+2HCl,
故答案為:A中產生的SO2與裝置內空氣中的O2進入B中與BaCl2溶液反應生成BaSO4沉淀;
③滴加濃硫酸之前打開彈簧夾,通入N2,排出裝置中的氧氣,然后滴加濃硫酸,Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,A中產生的白霧是濃硫酸的酸霧,所以B中的試劑是飽和NaHSO3,除去白霧,
故答案為:飽和NaHSO3;打開彈簧夾,通入N2,一段時間后關閉彈簧夾.
點評 本題考查了二氧化硫性質的實驗驗證分析判斷,物質性質的分析,裝置特征的判斷,反應條件的應用是解題關鍵,題目難度中等.


 初中學業考試導與練系列答案
初中學業考試導與練系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | +4 | B. | +2 | C. | +6 | D. | +3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 電池的發明和應用是化學家們對人類社會的重要貢獻之一.
電池的發明和應用是化學家們對人類社會的重要貢獻之一.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | ① | ② | ③ | 實驗結論 |  |
| A | 濃硫酸 | Cu | KMnO4溶液褪色 | SO2有漂白性 | |
| B | 濃鹽酸 | MnO2 | FeBr2溶液變為黃色 | 氧化性:Cl2>Br2 | |
| C | 稀硫酸 | 碳酸鈉 | CaCl2溶液無明顯變化 | CO2不與CaCl2溶液反應 | |
| D | 濃硫酸 | 蔗糖 | 溴水褪色 | 濃硫酸具有脫水性、吸水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 $→_{②}^{NaOH,乙醇}$
$→_{②}^{NaOH,乙醇}$ $→_{③}^{Br_{2}的CCl_{4}溶液}$B
$→_{③}^{Br_{2}的CCl_{4}溶液}$B
 ,名稱是環己烷.
,名稱是環己烷. +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$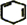 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反應速率小于4~6min的反應速率 |
| B.2~6min用Cl2表示的反應速率為0.9mol/(L•min) |
| C.增大壓強可以提高HCl轉化率 |
| D.平衡常數K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com