

| 物質 | 沸點 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |

分析 (1)①制取乙醚的溫度是混合液的溫度為140℃;
②乙醇具有揮發性,根據乙醇的性質來確定實驗目的;
③根據逆流冷卻的效果較好判斷進水口,根據乙醚的沸點判斷冰鹽水的作用;
④根據氣壓原理和重力原理來選擇防止倒吸的裝置;
⑤乙醇和濃硫酸在一定的溫度下發生消去反應生成乙烯,濃硫酸會將乙醇氧化為二氧化碳或是碳單質等;
(2)和酸性物質可以反應的是堿液;
(3)蒸餾可以將沸點不同的物質進行分離.
解答 解:(1)①制取乙醚的溫度是控制混合液的溫度為140℃,溫度計的水銀球要插在液面以下,故選裝置Ⅰ,故答案為:Ⅰ;
②乙醇具有揮發性,要通過分液漏斗下端連接的長導管插入到液面下加入,故答案為:防止乙醇揮發;
③逆流冷卻的效果較好,所以進水口為b,根據乙醚的沸點可知,冰鹽水的作用是冷凝液化乙醚,加以收集,故答案為:b;凝液化乙醚;
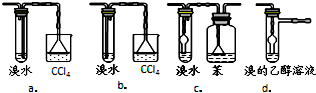
④c、d是可以防止倒吸的裝置,并且可以實現乙醚的分離,a中不能將溴乙烷和乙醚分離開來,b裝置會導致倒吸現象,故選c、d;
⑤乙醇和濃硫酸在一定的溫度下發生消去反應生成乙烯,濃硫酸的強氧化性會將乙醇氧化為二氧化碳或是碳單質等,發生的化學反應有:CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+9H2O;C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O;CH3CH2OH$→_{170℃}^{濃硫酸}$C2H4↑+H2O;CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O,
故答案為:CH3CH2OH+6H2SO4$\stackrel{△}{→}$2CO2↑+6SO2↑+9H2O、C+2H2SO4$\stackrel{△}{→}$CO2↑+2SO2↑+2H2O、CH3CH2OH$→_{170℃}^{濃硫酸}$C2H4↑+H2O、CH3CH2OH+2H2SO4$\stackrel{△}{→}$2C+2SO2↑+5H2O(其中兩個);
(2)分液步驟除去產品中的酸性雜質可以用堿液,如氫氧化鈉,
故答案為:NaOH;
(3)蒸餾可以將沸點不同的物質進行分離,乙醇的沸點較低,可用蒸餾的方法除去乙醚中的乙醇,
故答案為:乙醇(CH3CH2OH).
點評 本題重點考查學生乙醇的化學性質,結合實驗考查增加了試題的難度,綜合性強,要求學生具有分析和解決問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 單質的密度都很小,屬于輕金屬,且隨核電荷數的增加依次增大 | |
| B. | 單質的熔點都很低,導電性、導熱性都很好,如液態鈉可作核反應堆的傳熱介質 | |
| C. | 單質與氧氣反應時都只能生成氧化物或過氧化物 | |
| D. | 在Na、K、Rb三種單質中,Rb的熔點最高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 )可作為調味劑、緩沖劑、保水劑以及防腐保鮮劑,廣泛應用于飲料、肉制品、口服液等.有關說法錯誤是( )
)可作為調味劑、緩沖劑、保水劑以及防腐保鮮劑,廣泛應用于飲料、肉制品、口服液等.有關說法錯誤是( )| A. | 蘋果酸的酸性強于醋酸 | |
| B. | 分別對蘋果酸、蘋果酸鈉溶液微熱,溶液的pH均增大 | |
| C. | 蘋果酸在一定條件下發生消去反應可生成HOOCCH═CHCOOH | |
| D. | 蘋果酸在一定條件下發生取代反應可生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | 使石蕊試液變紅的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.225 | B. | 0.30 | C. | 0.36 | D. | 0.45 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com