
| A. | HA溶液中加入NaA固體后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$減小 | |
| B. | 常溫下,0.1mol/LHA溶液中水電離的c(H+)為10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反應,存在關系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常溫下,0.1mol/LNaA溶液水解常數為10-9 |
分析 A.$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$的比值為A-的水解平衡常數,水解平衡常數只受溫度影響;
B.HA為弱酸,則氫離子濃度小于0.1mol/L,水電離的氫離子濃度大于10-13mol/L;
C.根據混合液中的物料守恒判斷;
D.NaA的水解平衡常數K=$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$=$\frac{{K}_{w}}{K(HA)}$,據此帶入數據計算即可.
解答 解:A.$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$的比值為A-的水解平衡常數,加入NaA固體后,由于溫度不變,則水解平衡常數不變,故A錯誤;
B.由于HA為弱酸,則常溫下0.1mol/LHA溶液中氫離子濃度小于0.1mol/L,水電離的c(H+)一定大于$\frac{1×1{0}^{-14}}{0.1}$mol/L=10-13mol/L,故B錯誤;
C.NaA溶液中加入HCl溶液至恰好完全反應,NaA和HCl的物質的量相等,根據物料守恒可得:2c(Na+)=c(A-)+c(Cl-)+c(HA),故C錯誤;
D.NaA的水解平衡常數K=$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$=$\frac{{K}_{w}}{K(HA)}$=$\frac{1×1{0}^{-14}}{1×1{0}^{-5}}$=10-9,故D正確;
故選D.
點評 本題考查了離子濃度大小比較、鹽的水解原理、弱電解質的電離平衡等知識,題目難度中等,明確影響弱電解質的電離平衡、鹽的水解原理的因素為解答關鍵,注意掌握電荷守恒、物料守恒在判斷離子濃度大小中的應用方法.


 一線名師權威作業本系列答案
一線名師權威作業本系列答案科目:高中化學 來源: 題型:選擇題
| 選項 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 2 | 2 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶液中通入足量二氧化硫:SO2+2OH-═SO32-+H2O | |
| B. | 石灰水與醋酸反應:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 鈉與水反應:Na+2H2O═2OH-+Na++H2↑ | |
| D. | 向少量碳酸氫鈉溶液中滴加足量澄清石灰水:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
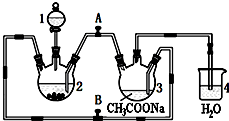 醋酸亞鉻水合物{[Cr(CH3COO)2]2•2H2O,相對分子質量為376}是一種深紅色晶體,不溶于冷水,是常用的氧氣吸收劑.實驗室中以鋅粒、三氯化鉻溶液、醋酸鈉溶液和鹽酸為主要原料制備醋酸亞鉻水合物,其裝置如右圖所示,且儀器2中預先加入鋅粒.已知二價鉻不穩定,極易被氧氣氧化,不與鋅反應.制備過程中發生的相關反應如下:
醋酸亞鉻水合物{[Cr(CH3COO)2]2•2H2O,相對分子質量為376}是一種深紅色晶體,不溶于冷水,是常用的氧氣吸收劑.實驗室中以鋅粒、三氯化鉻溶液、醋酸鈉溶液和鹽酸為主要原料制備醋酸亞鉻水合物,其裝置如右圖所示,且儀器2中預先加入鋅粒.已知二價鉻不穩定,極易被氧氣氧化,不與鋅反應.制備過程中發生的相關反應如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
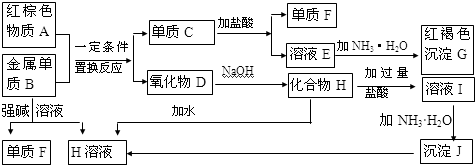
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
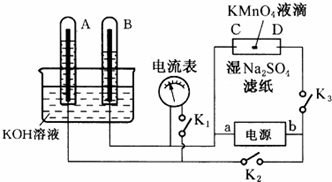
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
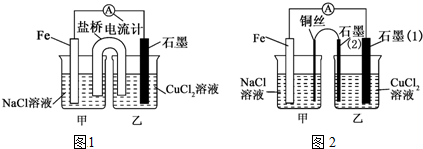
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com