
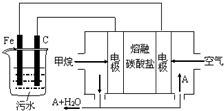
 電浮選凝聚法是工業上采用的一種污水處理方法:保持污水的pH在5.0~6.0之間,通過電解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉積下來,具有凈化水的作用.陰極產生的氣泡把污水中懸浮物帶到水面形成浮渣層,刮去(或撇掉)浮渣層,即起到了浮選凈化的作用.某科研小組用電浮選凝聚法處理污水,設計裝置示意圖,如圖所示.下列說法正確的是( )
電浮選凝聚法是工業上采用的一種污水處理方法:保持污水的pH在5.0~6.0之間,通過電解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉積下來,具有凈化水的作用.陰極產生的氣泡把污水中懸浮物帶到水面形成浮渣層,刮去(或撇掉)浮渣層,即起到了浮選凈化的作用.某科研小組用電浮選凝聚法處理污水,設計裝置示意圖,如圖所示.下列說法正確的是( )| A. | 該燃料電池是以熔融碳酸鹽為電解質,CH4為燃料,空氣為氧化劑,則負極的電極反應是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 實驗時若污水中離子濃度較小,導電能力較差,產生氣泡速率緩慢,無法使懸浮物形成浮渣,此時,可以向污水中加入適量的稀H2SO4 | |
| C. | 實驗過程中,若陰極產生2mol氣體,則燃料電池消耗11.2L CH4 | |
| D. | 為了使該電池長時間穩定運行,電池的電解質組成應保持穩定,電池工作時必須有部分A參加循環,則A物質是CO32- |
分析 燃料電池中,正極發生的反應是氧氣得電子被還原的過程,負極發生的反應是燃料失電子被氧化的過程;電池是以熔融碳酸鹽為電解質,可以循環利用的物質只有二氧化碳,甲烷燃料電池中,負極發生的反應是甲烷失電子被氧化的過程,電極反應式為CH4+4CO32--8e-=5CO2+2H2O,所以電解時鐵作陽極,因此主要發生Fe-2e-=Fe2+,陰極上氫離子得電子生成氫氣,據此進行分析.
解答 解:燃料電池中,正極發生的反應是氧氣得電子被還原的過程,負極發生的反應是燃料失電子被氧化的過程;電池是以熔融碳酸鹽為電解質,可以循環利用的物質只有二氧化碳,甲烷燃料電池中,負極發生的反應是甲烷失電子被氧化的過程,電極反應式為CH4+4CO32--8e-=5CO2+2H2O,所以電解時鐵作陽極,因此主要發生Fe-2e-=Fe2+,陰極上氫離子得電子生成氫氣,
A.甲烷燃料電池中,負極發生的反應是甲烷失電子被氧化的過程,電極反應式為:CH4+4CO32--8e-=5CO2+2H2O,故A正確;
B.沉降的原理是堿性環境下,讓鐵離子沉淀,若加入硫酸,則鐵離子不會產生沉淀,無法達到實驗目的,故B錯誤;
C.電解時陰極反應式為2H++2e-=H2↑,產生4.48 L氣體為標準狀況下時,轉移電子數為0.2mol,甲烷燃料電池中,負極發生的反應是甲烷失電子被氧化的過程,電極反應式為CH4+4CO32--8e-=5CO2+2H2O,則燃料電池消耗甲烷體積為:$\frac{0.2}{8}$×22.4L=0.56L,故C錯誤;
D.電池是以熔融碳酸鹽為電解質,可以循環利用的物質只有二氧化碳,使該燃料電池長時間穩定運行,電池工作時必須 有部分A物質參加循環.A物質是CO2,故D錯誤;
故選A.
點評 本題考查原電池和電解池工作原理,較為綜合,題目難度中等,做題時注意利用守恒的思考去解答,同時注意電極反應式的書寫方法,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:選擇題
| A. | 銅片加入FeCl3溶液中:Cu+2Fe3+═2Fe2++Cu2+ | |
| B. | 鹽酸中加入Ca CO3:CO32-+2H+═H2O+CO2↑ | |
| C. | Na2O2與H2O反應:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向Fe(OH)2中加入足量稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
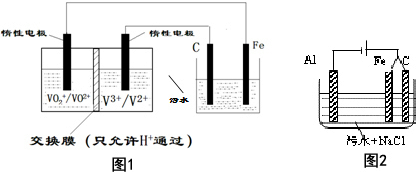
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
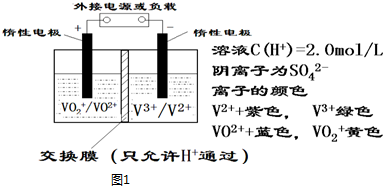
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F 是短周期元素組成的中學常見的物質,它們的轉化關系如圖所示(部分反應條件略去):
A、B、C、D、E、F 是短周期元素組成的中學常見的物質,它們的轉化關系如圖所示(部分反應條件略去): .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
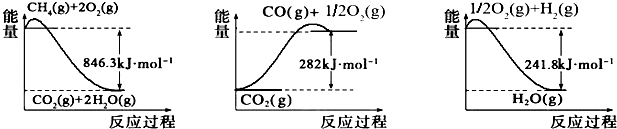
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2014年德美科學家因開發超分辨率熒光顯微鏡獲諾貝爾化學獎,使光學顯微鏡分辨率步入了納米時代.利用此類光學顯微鏡可以觀察活細胞內蛋白質等大分子 | |
| B. | 能量是可以互相轉化的.植物的光合作用可將太陽能轉變成化學能,單晶硅可將光能轉變成電能.原電池和電解池可實現化學能和電能的相互轉換 | |
| C. | 分類方法、統計方法、定量研究、實驗方法和模型化方法等是化學研究的常用方法 | |
| D. | 利用外接直流電源保護鐵質建筑物,屬于電化學中犧牲陽極的陰極保護法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
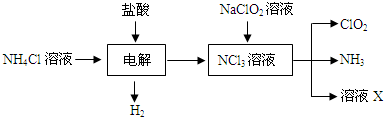
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com