0.7g鐵粉放入40mL 1mol/L的稀硝酸中,反應停止后溶液中的鹽是( )
A.只有Fe(NO3)3
B.只有Fe(NO3)2
C.Fe(NO3)3和Fe(NO3)2
D.不能確定
【答案】
分析:根據硝酸和金屬鐵的反應原理:Fe+4HNO
3=Fe(NO
3)
3+2H
2O+NO↑,如果金屬鐵過量時,鐵會和三價鐵繼續反應生成亞鐵離子,即Fe+2Fe(NO
3)
3=3Fe(NO
3)
2根據方程式計算即可.
解答:解:0.7g金屬鐵的物質的量為:
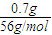
=0.0125mol,Fe+4HNO
3=Fe(NO
3)
3+2H
2O+NO↑,
硝酸的物質的量為0.04L×1mol/L=0.04mol,其中被還原的硝酸化合價降低,0.04mol中只有0.01mol,
質量是:0.01mol×63g/mol=0.63g,
根據方程式,0.04mol硝酸消耗鐵單質0.01mol,所以鐵粉剩余0.0125-0.01=0.0025mol;生成硝酸鐵0.01mol,
Fe+2Fe(NO
3)
3═3Fe(NO
3)
2,所以0.0025mol鐵粉消耗0.005mol硝酸鐵,生成0.0075mol硝酸亞鐵,
質量為:0.0075mol×180g/mol=1.35g,還剩0.01-0.005mol=0.005mol硝酸鐵,
質量為:0.005mol×242g/mol=1.21g,
所以,生成的硝酸鹽中有0.005mol硝酸鐵(質量為1.21g),0.0075mol硝酸亞鐵(質量為1.35g).
故選C.
點評:本題考查學生金屬鐵和硝酸的反應情況,注意鐵的量的多少對反應的影響,難度較大.

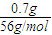 =0.0125mol,Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,
=0.0125mol,Fe+4HNO3=Fe(NO3)3+2H2O+NO↑,
