

| A. | 碳棒上有氣體放出,溶液酸性變弱 | |
| B. | a是正極,b是負極 | |
| C. | 導線中有電子流動,電流從a極到b極 | |
| D. | a極上發生了還原反應 |
分析 a的金屬活動性排在氫之前,b為碳棒,則該裝置構成原電池,a為負極失電子發生氧化反應、b為正極氫離子得電子生成氫氣發生還原反應,電子從負極沿導線流向正極,據此分析解答.
解答 解:a的金屬活動性排在氫之前,b為碳棒,則該裝置構成原電池,a為負極、b為正極;
A.碳棒b電極上氫離子得電子生成氫氣,溶液中氫離子濃度減小,溶液酸性變弱,故A正確;
B.通過以上分析知,a是負極、b是正極,故B錯誤;
C.該裝置構成原電池,所以有電子流動,則電流從正極b極到負極a極,故C錯誤;
D.a是負極,發生氧化反應,故D錯誤;
故選A.
點評 本題考查了原電池原理,明確正負極的判斷、電子流向、電極上的反應等知識點即可解答,注意電解質溶液中離子移動方向,為易錯點.


科目:高中化學 來源: 題型:解答題
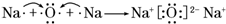 .A、B兩種元素還可以形成A2B2型化合物,寫出該化合物的電子式
.A、B兩種元素還可以形成A2B2型化合物,寫出該化合物的電子式 .
.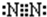 ;
; ;
;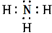 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 能使品紅溶液褪色 | B. | 能與NaOH溶液反應 | ||
| C. | 能與H2O反應生成H2SO4 | D. | 一定條件下能與O2反應生成SO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在101kPa時,1mol物質完全燃燒時所放出的熱量,叫做該物質的燃燒熱 | |
| B. | 熱化學方程式各物質前的化學計量數只表示分子個數不代表物質的量 | |
| C. | 燃燒熱或中和熱是反應熱的種類之一 | |
| D. | 對于H2+Cl2$\frac{\underline{\;點燃\;}}{\;}$2HCl△H<0,斷開1mol H-H鍵和1mol Cl-Cl鍵所吸收的總能量大于形成2mol H-Cl鍵所放出的能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L H2含有的分子數為NA | |
| B. | 標準狀況下,80g SO3的體積為22.4L | |
| C. | 18g H2O在標準狀況下的體積是22.4L | |
| D. | 物質的量濃度為0.5mol/L的MgCl2溶液中,含有Cl-個數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸點/℃ | -57.7 | 12.8 | - | 315 | - |
| 熔點/℃ | -70.0 | -107.2 | - | - | - |
| 升華溫度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
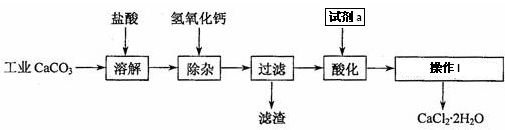
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com