
【題目】按要求書寫方程式
(1)高溫下鋁與氧化鐵反應的化學方程式 。
(2)惰性電極電解AgNO3溶液的離子方程式 。
(3)工業制硝酸吸收塔中發生反應的離子方程式 。
科目:高中化學 來源: 題型:
【題目】化學與人類生產、生活、可持續發展密切相關,下列說法不正確的是
A.空氣中PM2.5(2.5微米以下的顆粒物)的存在一定能夠形成丁達爾效應
B.高溫能殺死流感病毒是因為構成病毒的蛋白質受熱變性
C.聚乙烯食品包裝袋、食物保鮮膜都是無毒的高分子化合物材料
D.水體的富營養化與含N、P洗衣粉廣泛使用有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】影響化學反應速率的因素很多,某課外興趣小組用實驗的方法通過圖1所示裝置研究反應速率的有關問題。

⑴取一段鎂條,用砂紙擦去表面的氧化膜,使鎂條浸入錐形瓶內足量的稀鹽酸中。足量鎂條與一定量鹽酸反應生成H2的量與反應時間的關系曲線如圖2所示。
①請在圖3的方框中畫出上述反應的速率與時間的關系曲線。

②在前4min內,鎂條與鹽酸的反應速率逐漸加快,在4min之后,反應速率逐漸減慢,請簡述其原_____________________________。
(2)某同學發現,純度、質量、表面積都相同的兩鋁片與H+濃度相同的鹽酸和硫酸在同溫同壓下反應時產生氫氣的速率差別很大,鋁和鹽酸反應速率更快。他決定對其原因進行探究。填寫下列空白:
①該同學認為:由于預先控制了反應的其他條件,那么,兩次實驗時反應的速率不一樣的原因,只有以下五種可能:
原因Ⅰ:Cl-對反應具有促進作用,而SO2- 4對反應沒有影響;
原因Ⅱ:Cl-對反應沒有影響,而SO2- 4對反應具有阻礙作用;
原因Ⅲ:______________________________;
原因Ⅳ:Cl-、SO2- 4均對反應具有促進作用,但Cl-影響更大;
原因Ⅴ:_____________________________。
②該同學設計并進行了兩組實驗,即得出了正確結論。他取了兩片等質量、外形和組成相同、表面經過砂紙充分打磨的鋁片,分別放入到盛有同體積、c(H+)相同的稀硫酸和鹽酸的試管(兩試管的規格相同)中:
a.在盛有硫酸的試管中加入少量NaCl或KCl固體,觀察反應速率是否變化;
b.在盛有鹽酸的試管中加入少量Na2SO4或K2SO4固體,觀察反應速率是否變化。
若觀察到實驗a中_____________,實驗b中_________________,則說明原因Ⅰ是正確的。依次類推。該同學通過分析實驗現象,得出了結論:Cl-對反應具有加速作用。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 強電解質一定是離子化合物 B. 強電解質、弱電解質的電離都是吸熱過程
C. 強電解質的飽和溶液一定是濃溶液 D. 強電解質在水中一定能全部溶解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知鉛蓄電池充放電的總反應為:![]() ,下列關于鉛蓄電池的說法正確的是( )
,下列關于鉛蓄電池的說法正確的是( )
A. 在放電時,兩極質量均增加
B. 在充電時,電池中硫酸的濃度不斷變小
C. 在放電時,負極發生的反應是 Pb + 2e- + SO42-=PbSO4
D. 在放電時,正極發生的反應是 PbSO4 + 2e- =Pb + SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.某學生利用下圖裝置測定反應過程中所放出的熱量并計算中和熱。所用藥品為50ml 0.50mol·L-1鹽酸與50ml 0.55mol·L-1NaOH溶液。請回答下列問題:
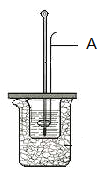
(1)圖中A儀器名稱為__________。其作用為__________。
(2)該同學做實驗時有些操作不規范,造成測得中和熱的數值偏低,請你分析可能的原因是____________。
A.測量鹽酸的溫度后,溫度計沒有用水沖洗干凈,立即去測量氫氧化鈉溶液的溫度
B.把量筒中的氫氧化鈉溶液一次性快速倒入小燒杯
C.做本實驗的當天室溫較高
D.將50mL0.55mol/L氫氧化鈉溶液取成了50mL0.55mol/L的氨水
II.(1)原電池是將化學能轉化為電能的裝置,現將下列化學反應設計成帶鹽橋原電池,請你畫出該原電池裝置簡圖(標明電極材料名稱和試劑名稱):Zn+CuSO4= ZnSO4+Cu_________
(2)鹽橋中的陰離子向_________(填正極或負極)遷移。
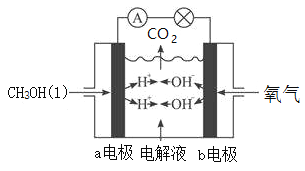
III.下圖為甲醇(CH3OH)燃料電池裝置,該裝置能量轉化率可達90%,當通入67.2L(標況下)氧氣時,產生1306kJ電能,則甲醇液體的燃燒熱的熱化學方程式為____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com