
【題目】常溫下,向![]() 溶液中滴加少量
溶液中滴加少量![]() 溶液,反應原理如圖所示。關于該反應過程的說法正確的是
溶液,反應原理如圖所示。關于該反應過程的說法正確的是

A.該反應過程中,![]() 是
是![]() 是
是![]() B.當有
B.當有![]() 生成時,轉移
生成時,轉移![]() 電子
電子
C.在![]() 分解過程中,溶液的
分解過程中,溶液的![]() 逐漸降低D.
逐漸降低D.![]() 的氧化性比
的氧化性比![]() 強,還原性比
強,還原性比![]() 弱
弱
【答案】B
【解析】
根據反應原理圖,H2O2+M+H+→H2O+Mˊ的過程中H2O2被還原成H2O,Mˊ+H2O2→M+O2+H+的過程中H2O2被氧化成O2,根據氧化還原反應的特點,M為Fe2+,Mˊ為Fe3+,據此分析作答。
A. 根據分析, M是![]() ,Mˊ是
,Mˊ是![]() ,故A錯誤;
,故A錯誤;
B. 圖示中生成O2的反應為2Fe3++H2O2=2Fe2++O2↑+2H+,反應過程中O元素的化合價由-1價升至0價,因此當有![]() 生成時,轉移
生成時,轉移![]() 電子,故B正確;
電子,故B正確;
C. 圖示中的反應為2Fe3++H2O2=2Fe2++O2↑+2H+、2Fe2++H2O2+2H+=2Fe3++2H2O,則總反應為2H2O2![]() 2H2O+O2↑,在
2H2O+O2↑,在![]() 分解過程中生成了H2O,溶液變稀,則溶液的
分解過程中生成了H2O,溶液變稀,則溶液的![]() 會逐漸增大,故C錯誤;
會逐漸增大,故C錯誤;
D. 根據2Fe3++H2O2=2Fe2++O2↑+2H+說明H2O2的還原性強于Fe2+,2Fe2++H2O2+2H+=2Fe3++2H2O說明H2O2的氧化性強于Fe3+,故D錯誤;
綜上所述,答案為B。


 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源: 題型:
【題目】化合物![]() 在一定波長的光照射下發生分解反應,反應物濃度隨反應時間變化如下圖所示,計算反應在4-8min內的平均反應速率和推測反應16min時反應物的濃度,結果應是( )
在一定波長的光照射下發生分解反應,反應物濃度隨反應時間變化如下圖所示,計算反應在4-8min內的平均反應速率和推測反應16min時反應物的濃度,結果應是( )
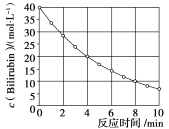
A.![]() 和2.0mol/L
和2.0mol/L
B.![]() 和2.5mol/L
和2.5mol/L
C.![]() 和3.0mol/L
和3.0mol/L
D.![]() 和3.0mol/L
和3.0mol/L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莽草酸可用于合成藥物達菲,其結構簡式如圖,下列關于莽草酸的說法正確的是( )
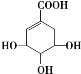
A.分子式為C7H10O5,屬于芳香族化合物,易溶于水
B.分子中含有3種官能團,可以發生加成、氧化、取代等反應
C.在水溶液中,1mol莽草酸最多可電離出4molH+
D.1mol莽草酸與足量的NaHCO3溶液反應可放出4molCO2氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2020年初,突如其來的新型冠狀肺炎在全世界肆虐,依據研究,含氯消毒劑可以有效滅活新冠病毒,為阻斷疫情做出了巨大貢獻。二氧化氯(C1O2)就是其中一種高效消毒滅菌劑。但其穩定性較差,可轉化為NaC1O2保存。分別利用吸收法和電解法兩種方法得到較穩定的NaClO2。其工藝流程示意圖如圖所示:

已知:1.純C1O2易分解爆炸,一般用稀有氣體或空氣稀釋到10%以下。
2.長期放置或高于60℃時NaC1O2易分解生成NaC1O3和NaCl
(1)步驟1中,生成C1O2的離子方程式是___,通人空氣的作用是___。
(2)方法1中,反應的離子方程式是___,利用方法1制NaC1O2時,溫度不能超過20℃,可能的原因是___。
(3)方法2中,NaC1O2在___生成(選填“陰極”或“陽極”)。
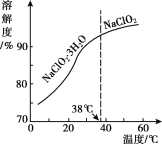
(4)NaC1O2的溶解度曲線如圖所示,步驟3中從NaC1O2溶溶液中獲得NaC1O2的操作是___。
(5)為測定制得的晶體中NaC1O2的含量,做如下操作:
①稱取a克樣品于燒杯中,加入適量蒸餾水溶解后加過量的碘化鉀晶體,再滴入適量的稀硫酸,充分反應。將所得混合液配成100mL待測溶液。
②移取25.00mL待測溶液于錐形瓶中,用bmolL-1Na2S2O3標準液滴定,至滴定終點。重復2次,測得消耗標準溶液的體積的平均值為cmL(已知:I2+2S2O32-=2I-+S4O62-)。樣品中NaC1O2的質量分數為___。(用含a、b、c的代數式表小)。在滴定操作正確無誤的情況下,測得結果偏高,可能的原因是___(用離子方程式和文字表示)。
(6)NaC1O2使用時,加入稀鹽酸即可迅速得到C1O2。但若加入鹽酸濃度過大,則氣體產物中Cl2的含量會增大,原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表前四周期的一部分,下列有關R、W、X、Y、Z五種元素的敘述中,正確的是( )
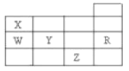
A.常壓下五種元素的單質中,Z單質的沸點最高
B.Y、Z的陰離子電子層結構都與R原子的相同
C.W的氫化物比X的氫化物穩定
D.Y元素的非金屬性比W元素的非金屬性強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 向400mL某濃度的稀硝酸中加入Wg鐵粉(還原產物只有NO),充分反應后,鐵粉減少16.8 g且鐵粉有剩余,繼續向容器中加入足量的稀硫酸,會產生氣體A。回答下列問題:
(1)稀硝酸的物質的量濃度是_____________ mol·L1
(2)氣體A中若含有H2,則W的值一定要大于__________g.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】吡唑類化合物是重要的醫用中間體,如圖是吡唑類物質L的合成路線。
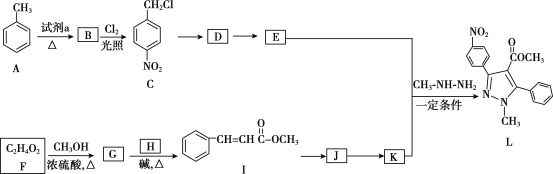
已知:R1—CHO+R2CH2—COOR3![]()
R1—CHO+R2NH2![]() R1—CH=N—R2
R1—CH=N—R2
(1)試劑a是__。
(2)C生成D的反應類型是__。
(3)D生成E的化學方程式是___。
(4)生成G的化學方程式是__。
(5)H的結構簡式是__。
(6)寫出符合下列條件的I的同分異構體的結構簡式__。
a.是反式結構
b.能發生銀鏡反應
c.苯環上的一氯代物有2種
d.1mol該有機物能與2mol氫氧化鈉反應
(7)K的分子式是C10H8O2,K的結構簡式是__。
(8)以2-甲基丙烯和乙酸為原料,選用必要的無機試劑,合成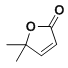 ,寫出合成路線__(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)
,寫出合成路線__(用結構簡式表示有機物,用箭頭表示轉化關系,箭頭上注明試劑和反應條件)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢定影液的主要成分為Na3[Ag(S2O3)2],用廢定影液為原料制備AgNO3的實驗流程如下:

(1) “沉淀”步驟中生成Ag2S沉淀,檢驗沉淀完全的操作是________。
(2) “反應”步驟中會生成淡黃色固體,該反應的化學方程式為________。
(3) “除雜”需調節溶液pH至6。測定溶液pH的操作是________。
(4) 已知:2AgNO3![]() 2Ag+2NO2↑+O2↑,2Cu(NO3)2
2Ag+2NO2↑+O2↑,2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑。AgNO3粗產品中常含有Cu(NO3)2,請設計由AgNO3粗產品獲取純凈AgNO3的實驗方案:______________________,蒸發濃縮,冷卻結晶,過濾,洗滌,干燥,得到純凈的AgNO3。(實驗中須使用的試劑有稀硝酸、NaOH溶液、蒸餾水)
2CuO+4NO2↑+O2↑。AgNO3粗產品中常含有Cu(NO3)2,請設計由AgNO3粗產品獲取純凈AgNO3的實驗方案:______________________,蒸發濃縮,冷卻結晶,過濾,洗滌,干燥,得到純凈的AgNO3。(實驗中須使用的試劑有稀硝酸、NaOH溶液、蒸餾水)
(5) 蒸發濃縮AgNO3溶液的裝置如下圖所示。使用真空泵的目的是________;判斷蒸發濃縮完成的標志是____________________。
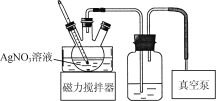
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯是非常重要的有機物,它的產量通常用來衡量一個國家石油化工發展水平。請回答下列問題:
(1)工業上以乙烯為原料可合成一重要有機高分子化合物,該材料可用于食品包裝。合成該物質的化學方程式為________,反應類型是_____。
(2)為探究實驗室制乙烯及乙烯和溴水的反應,甲同學設計了如圖所示的實驗裝置。制備乙烯的化學方程式:________;乙烯使溴水褪色的化學方程式:__________,反應類型_____。
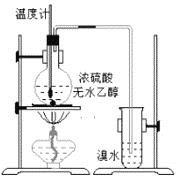
(3)寫出下列物質所對應的同分異構體的結構簡式:
①![]() 的同分異構體的結構簡式____________________。
的同分異構體的結構簡式____________________。
②![]() 的同分異構體的結構簡式____________________。
的同分異構體的結構簡式____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com