
| 離子 | Na+ | Mg2+ | Cl- | SO42- |
| 濃度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
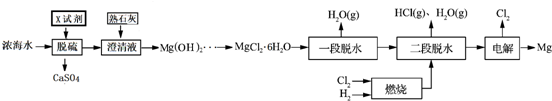
分析 濃海水加入氯化鈣,可生成硫酸鈣,一達到脫硫的目的,加入熟石灰,可生成氫氧化鎂,進而生成MgCl2•6H2O,一段脫水生成MgCl2•2H2O,在通入HCl的氛圍中加入氯化鎂溶液得到氯化鎂,電解可得到鎂和氯氣,
(1)由表中數據可知質量濃度最小的為Mg2+,可循環的是Cl2、HCl;
(2)X為氯化鈣,可生成硫酸鈣;
(3)由題意知Mg(OH)Cl與陰極產生的Mg反應,產生MgO,同時在陰極上生成氫氣;
(4)由題給數據可知1m3濃海水含有m(Mg2+)=1000L×28.8g/L,則生成Mg(OH)2的物質的量為$\frac{1000×28.8}{24}×80%$,經二段脫水生成MgCl2的物質的量為$\frac{1000×28.8}{24}×80%$×90%,質量為$\frac{1000×28.8}{24}×80%$×90%mol×98g/mol=84672g;
(5)正極發生還原反應,V2O5被還原生成V2O4•Li2O;
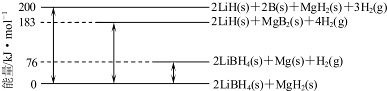
(6)由圖可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
利用蓋斯定律將-④-②的熱化學方程式.
解答 解:濃海水加入氯化鈣,可生成硫酸鈣,一達到脫硫的目的,加入熟石灰,可生成氫氧化鎂,進而生成MgCl2•6H2O,一段脫水生成MgCl2•2H2O,在通入HCl的氛圍中加入氯化鎂溶液得到氯化鎂,電解可得到鎂和氯氣,
(1)由表中數據可知質量濃度最小的為Mg2+,上述流程中氯氣和與氫氣反應生成氯化氫,氯化氫可與氫氧化鎂反應制備氯化鎂,則可循環的是Cl2、HCl,
故答案為:Mg2+;Cl2、HCl;
(2)X為氯化鈣,可生成硫酸鈣,一達到脫硫的目的,故答案為:CaCl2;
(3)由題意知Mg(OH)Cl與陰極產生的Mg反應,產生MgO,反應的化學方程式為2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑,
故答案為:2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑;
(4)由題給數據可知1m3濃海水含有m(Mg2+)=1000L×28.8g/L,則生成Mg(OH)2的物質的量為$\frac{1000×28.8}{24}×80%$,經二段脫水生成MgCl2的物質的量為$\frac{1000×28.8}{24}×80%$×90%,質量為$\frac{1000×28.8}{24}×80%$×90%mol×98g/mol=84672g,
故答案為:84672;
(5)正極發生還原反應,V2O5被還原生成V2O4•Li2O,電極方程式為V2O5+2Li++2e-=V2O4•Li2O,故答案為:V2O5+2Li++2e-=V2O4•Li2O;
(6)由圖可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1,
故答案為:-93 kJ•mol-1.
點評 本題考查混合物分離提純的綜合應用及海水資源利用等,為高頻考點,把握分離流程中的反應及混合物分離方法為解答的關鍵,注意把握題中信息,能夠正確提取題中信息,聯系所學知識進行解答,試題充分培養了學生的分析、理解能力及靈活應用所學知識的能力本題涉及熱化學方程式的書寫,蓋斯定律的應用,電化學知識,綜合性非常強,難度大


 輕松奪冠全能掌控卷系列答案
輕松奪冠全能掌控卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
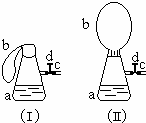 如圖(Ⅰ)中錐形瓶a內放入43.8g10%的稀鹽酸,b是未充氣的氣球,里邊放有4g碳酸鈣粉末,將它緊緊套在瓶a口上,膠管c套在瓶的側口,并用彈簧夾d夾緊(瓶口和側口都不漏氣).將圖Ⅰ的裝置在托盤天平上稱量,質量為W1克.根據實驗現象填寫下列空白:
如圖(Ⅰ)中錐形瓶a內放入43.8g10%的稀鹽酸,b是未充氣的氣球,里邊放有4g碳酸鈣粉末,將它緊緊套在瓶a口上,膠管c套在瓶的側口,并用彈簧夾d夾緊(瓶口和側口都不漏氣).將圖Ⅰ的裝置在托盤天平上稱量,質量為W1克.根據實驗現象填寫下列空白:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
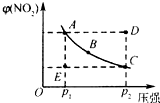 對于N2O4(g)?2NO2(g)在溫度一定時,平衡體系中NO2的體積分數V(NO2)%隨壓強的變化情況如圖所示(實線上的任何一點為對應壓強下的平衡點).
對于N2O4(g)?2NO2(g)在溫度一定時,平衡體系中NO2的體積分數V(NO2)%隨壓強的變化情況如圖所示(實線上的任何一點為對應壓強下的平衡點).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
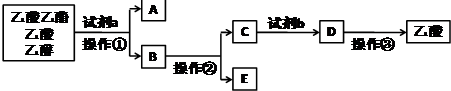
| A. | 操作①用到的玻璃儀器主要有分液漏斗、燒杯 | |
| B. | 工業制備無水E物質的方法是在E中加生石灰后進行操作② | |
| C. | 試劑b可用硫酸 | |
| D. | 操作③用到的儀器和用品主要有漏斗、燒杯、玻璃棒、濾紙 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
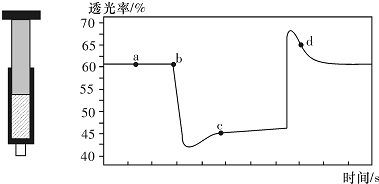
| A. | b點的操作是拉伸注射器 | |
| B. | d點:v(正)>v(逆) | |
| C. | c點與a點相比,c(NO2)增大,c(N2O4)減小 | |
| D. | 若不忽略體系溫度變化,且沒有能量損失,則T(b)<T(c) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
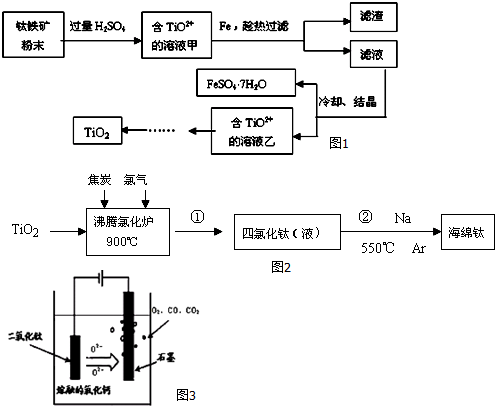
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
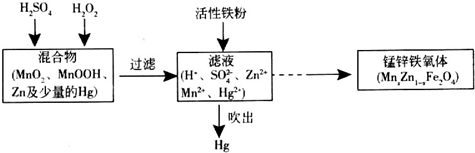
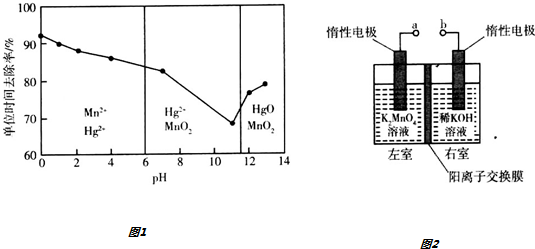
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com