
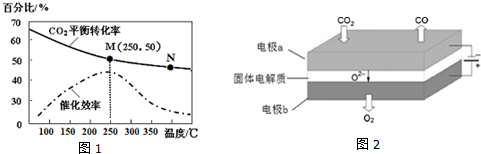
分析 (1)燃燒熱是在101KP時,1mol可燃物完全燃燒生成穩定的氧化物時所放出的熱量,C元素要轉化為二氧化碳,H元素要轉化為液態水,依據H2和CH2=CH2的燃燒熱分別為285.8kJ/mol和1411kJ/mol,書寫熱化學方程式,根據蓋斯定律計算得到6H2(g)+2CO2(g)$\stackrel{催化劑}{?}$ CH2=CH2(g)+4H2O(g)△H;
(2)①溫度升高化學反應速率加快,催化劑的催化效率降低;
②該反應是放熱反應,升溫平衡逆向移動;
③反應是放熱反應,溫度升高平衡逆向進行;
④溫度越低催化劑活性越小,反應速率越慢;
(3)圖中M點時二氧化碳的轉化率50%,結合化學平衡三行計算列式得到,反應是氣體體積減小的反應增大壓強平衡正向進行;
(4)根據題干信息,反應物為CO2與Li4SiO4,生成物有Li2CO3,根據質量守恒進行解答;
(5)①與電源負極相連的電極a為陰極,與電源正極相連的電極b為陽極,a電極上是二氧化碳得到電子發生還原反應;
②將CO2轉化為高熱值的燃料CO,依據原子守恒分析反應生成一氧化碳和氧氣.
解答 解:(1)H2和CH2=CH2的燃燒熱分別為285.8kJ/mol和1411kJ/mol,熱化學方程式為:
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
②CH2=CH2 (g)+3O2(g)→2CO2(g)+2H2O(l),△H=-1411kJ/mol,
③H2O(g)=H2O(l)△H=-44kJ/mol
蓋斯定律計算①×6-②-③×4得到:6H2(g)+2CO2(g)$\frac{\underline{\;催化劑\;}}{\;}$CH2=CH2(g)+4H2O(g)△H=-127.8kJ/mol,
故答案為:-127.8;
(2)①化學反應速率隨溫度的升高而加快,催化劑的催化效率降低,所以v(M)有可能小于v(N),故①不正確;
②溫度低于250℃時,隨溫度升高平衡逆向進行乙烯的產率減小,故②不正確;
③升高溫度二氧化碳的平衡轉化率減低,則升溫平衡逆向移動,所以M化學平衡常數大于N,故③正確;
④為提高CO2的轉化率,平衡正向進行,反應是放熱反應,低的溫度下進行反應,平衡正向進行,但催化劑的活性、反應速率減小,故④不正確;
故答案為:①②④;
(3)若在密閉容器中充入體積比為 3:1的 H2 和CO2,設為3mol,1mol,則圖中M點時二氧化碳轉化率50%,
6H2(g)+2CO2(g)$\frac{\underline{\;催化劑\;}}{\;}$CH2=CH2(g)+4H2O(g)
起始量(mol) 3 1 0 0
變化量(mol) 1.5 0.5 0.25 1
平衡量(mol) 1.5 0.5 0.25 1
產物CH2=CH2的體積分數=$\frac{0.25}{1.5+0.5+0.25+1}$×100%=7.7%,
反應前后氣體體積減小,若要進一步提高乙烯的體積分數,可采取的措施有增大壓強平衡正向進行,
故答案為:7.7%,增大壓強;
(4)科學家開發了一種新型陶瓷(主要成分為Li4SiO4),在500℃時可高效吸收CO2,同時生成 Li2CO3,該材料在 700℃時可再生循環,反應的化學方程式為:CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3,
故答案為:CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3;
(5))①CO2+H2O$\frac{\underline{\;通電\;}}{高溫}$CO+H2+O2,二氧化碳中的碳元素化合價降低,被還原,水中的氫元素化合價降低被還原,反應物中的氧元素化合價升高,被氧化,失去電子發生氧化反應生成氧氣,與電源負極相連的電極a為陰極,與電源正極相連的電極b為陽極,a電極上是二氧化碳得到電子發生還原反應生成,
故答案為:還原;
②將CO2轉化為高熱值的燃料CO,依據原子守恒分析反應生成一氧化碳和氧氣,反應的化學方程式為:2CO2=2CO+O2,
故答案為:2CO2=2CO+O2.
點評 本題考查了熱化學方程式書寫、化學平衡的計算、原電池和電解池原理的理解應用,注意化學方程式書寫方法,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 加入KSCN溶液不一定變紅色 | B. | 溶液中一定含Fe2+ | ||
| C. | 溶液中一定含Cu2+ | D. | 剩余固體中一定含Cu和Fe |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.5 mol/L | B. | 0.5mol/L | C. | 0.75 mol/L | D. | 0.25 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 礦物透閃石是制作玉器的一種原料,其化學式可用CaxMgySi8O22(OH)m表示.
礦物透閃石是制作玉器的一種原料,其化學式可用CaxMgySi8O22(OH)m表示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油、沼氣、天然氣、植物油都屬于可再生能源 | |
| B. | 應用蓋斯定律,可計算某些難以直接測量的反應焓變 | |
| C. | 水蒸氣變為液態水時放出的能量就是該變化的反應熱 | |
| D. | 同溫同壓下,H2(g)+Cl2(g)═2HCl(g)在光照和點燃條件下的△H不同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 科學家開發出一種“潔凈煤技術”,通過向地下煤層“氣化爐”中交替鼓入空氣和水蒸氣的方法,連續產出高熱值的煤炭氣,其主要成分是CO和H2.“氣化爐”中主要反應有:
科學家開發出一種“潔凈煤技術”,通過向地下煤層“氣化爐”中交替鼓入空氣和水蒸氣的方法,連續產出高熱值的煤炭氣,其主要成分是CO和H2.“氣化爐”中主要反應有:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+) | |
| B. | 該溶液中:c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-) | |
| C. | 加水稀釋該溶液,恢復至原溫度,pH增大,Kw不變 | |
| D. | 該溶液pH約為13的原因:CO32-+H2O═HCO3-+OH- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com