
(14分)(1)Na2SO3溶液蒸干得到的固體物質是___________,原因是______________.
(2)碳酸氫鋇溶液蒸干得到的固體物質是___________,原因是___________________.
(3)鹽酸與硫酸濃度各為1mol/L 的混合酸10mL,加熱濃縮至1mL,最后得到的溶液濃度
為_________,原因是_____________________________________________________。
(4)與c(H+)·c(OH-)=kw類似,FeS飽和溶液中存在:FeS(s)  Fe
Fe
 +S
+S
 ,
,
c(Fe )·c(s
)·c(s )=ksp。常溫下ksp=8.1×10-17。(溶液密度為1.0g/cm3)。
)=ksp。常溫下ksp=8.1×10-17。(溶液密度為1.0g/cm3)。
理論上FeS的溶解度為___________________。
科目:高中化學 來源: 題型:
(每空2分,共14分)A、B、C、D均為含苯環的化合物,且相對分子質量B>A>C,已知有機物A的結構簡式為: 
(1)A既能和NaOH溶液反應,又能和NaHCO3溶液反應,寫出A和 NaHCO3溶液反應的化學方程式______ __________。
(2)①有機物B在濃硫酸存在條件下,相互作用生成一種環狀酯(如下圖)則有機物B的結構簡式為 _。
②等物質的量B與Na、NaOH、NaHCO3充分反應,消耗Na、NaOH、NaHCO3的物質的量之比為___ _____。
(3) 1molA、C完全燃燒,消耗O2的質量相等,且1molC能和1molNa完全反應,寫出含碳原子數最少的C的結構簡式_____ ___,寫出C與濃溴水的反應的化學方程式 。
(4)D和B互為同分異構體,且知其苯環上連有三個取代基,苯環上的一氯代物只有兩種,D不與NaHCO3溶液反應,能與Na和NaOH反應,等質量的D消耗Na和NaOH的物質的量之比為2∶3,則D的結構簡式為 、 。(只寫二種)
查看答案和解析>>
科目:高中化學 來源: 題型:
(14分)(1)448mL某氣體在標準狀況下的質量為1.28g,該氣體的摩爾質量約為
(2)12.4gNa2R中含Na+0.4mol,則Na2R的摩爾質量為 ,R的相對原子質量為
(3)5molCO2的質量是_________;在標準狀況下所占的體積約為__________;所含的分子數目約為____________________;所含氧原子的數目約為___________________。
查看答案和解析>>
科目:高中化學 來源:2012屆云南省建水一中高三9月份月考理科綜合試題(化學部分) 題型:填空題
(14分)
Ⅰ.(每空1分) 已知某工業廢水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通過下述過程可從該廢水中回收硫酸銅晶體及其他物質。
(1)步驟1需用到的玻璃儀器除燒杯外有 。
(2)步驟2中需加入某種試劑后再將混合物分離,該試劑是(填化學式) ,固體殘渣的成分是(填化學式) 。
(3)步驟3中涉及的操作是:蒸發濃縮、 、過濾、烘干。
(4)步驟2應該在通風櫥中進行,原因是 。
Ⅱ.((2)為1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干種,依次進行下列實驗,觀察到的現象記錄如下:①加入鹽酸,有無色氣體生成;②向原溶液中滴加氯水,無氣體產生,再加CCl4振蕩,靜置,CCl4層呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,過濾;④在濾液中加AgNO3和HNO3的混合液,有白色沉淀產生.試回答:(提示:氯氣會氧化SO為SO)
(1)原溶液中肯定存在的離子是 ,肯定沒有的離子是 ;
(2)若步驟③改用BaCl2和鹽酸的混合溶液,對判斷(1)結論有無影響 ;
(3)步驟②中發生反應的離子方程式為 、 .
查看答案和解析>>
科目:高中化學 來源:2011-2012學年陜西省長安一中高一上學期期中考試化學試卷 題型:填空題
(14分)(I)下列離子均為中學化學常見的離子:Na+、Ba2+、Mg2+、Al3+、Fe3+、Cu2+、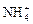 、H+、Cl-、
、H+、Cl-、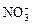 、
、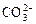 、
、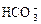 、
、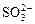 、OH-。上述離子中,在強酸性溶液里不可能大量存在的是____________;在強堿性溶液中不可能大量存在的離子有____________;既不能在強酸性溶液里大量存在,也不能在強堿性溶液里大量存在的是______;無論在強酸性溶液還是強堿性溶液里,都可以大量存在的是____________
、OH-。上述離子中,在強酸性溶液里不可能大量存在的是____________;在強堿性溶液中不可能大量存在的離子有____________;既不能在強酸性溶液里大量存在,也不能在強堿性溶液里大量存在的是______;無論在強酸性溶液還是強堿性溶液里,都可以大量存在的是____________
(II)將適當的物質填在下邊的橫線上
(1)Cu2++______=Fe2++______;
(2) ______+H+=______+H2O+CO2↑;
(3) 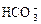 +______=
+______=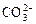 +______;
+______;
查看答案和解析>>
科目:高中化學 來源:2011-2012學年云南省高三9月份月考理科綜合試題(化學部分) 題型:填空題
(14分)
Ⅰ.(每空1分) 已知某工業廢水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通過下述過程可從該廢水中回收硫酸銅晶體及其他物質。

(1)步驟1需用到的玻璃儀器除燒杯外有 。
(2)步驟2中需加入某種試劑后再將混合物分離,該試劑是(填化學式) ,固體殘渣的成分是(填化學式) 。
(3)步驟3中涉及的操作是:蒸發濃縮、 、過濾、烘干。
(4)步驟2應該在通風櫥中進行,原因是 。
Ⅱ.((2)為1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干種,依次進行下列實驗,觀察到的現象記錄如下:①加入鹽酸,有無色氣體生成;②向原溶液中滴加氯水,無氣體產生,再加CCl4振蕩,靜置,CCl4層呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,過濾;④在濾液中加AgNO3和HNO3的混合液,有白色沉淀產生.試回答:(提示:氯氣會氧化SO為SO)
(1)原溶液中肯定存在的離子是 ,肯定沒有的離子是 ;
(2)若步驟③改用BaCl2和鹽酸的混合溶液,對判斷(1)結論有無影響 ;
(3)步驟②中發生反應的離子方程式為 、 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com