
【題目】有機物H是合成免疫抑制劑藥物霉酚酸的中間體,可由如下路徑合成得到. 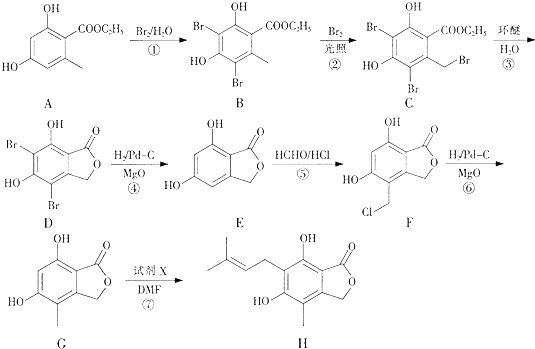
(1)有機物A中的含氧官能團的名稱為 .
(2)由C轉化為D的反應類型為 .
(3)反應⑦除了得到有機物H外還得到HBr,試劑X的結構簡式為 .
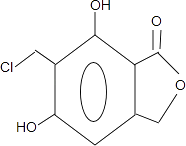
(4)步驟⑤可得到副產品有機物J,有機物J和有機物F互為同分異構體,寫出有機物J的結構簡式:(任寫一種).
(5)E的一種同分異構體滿足下列條件: Ⅰ.可以發生銀鏡反應,且能夠與NaHCO3反應產生CO2;
Ⅱ.是芳香族化合物,且核磁共振氫譜圖顯示分子中有4種不同化學環境的氫.
寫出該同分異構體的結構簡式: .
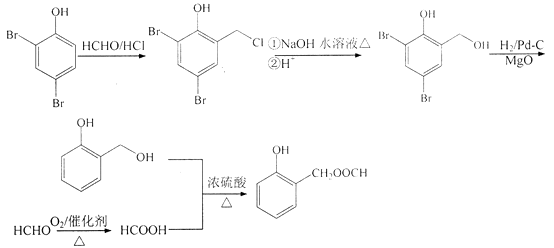
(6)已知:直接與苯環相連的鹵素原子難以與NaOH水溶液發生取代反應.根據已有知識并結合相關信息,寫出以 ![]() HCHO為原料制備
HCHO為原料制備 ![]() 合成路線流程圖(無機試劑任用).合成路線流程圖示例如下: CH3CH2OH
合成路線流程圖(無機試劑任用).合成路線流程圖示例如下: CH3CH2OH ![]() H2C=C2H
H2C=C2H ![]()
![]()
【答案】
(1)酚羥基、酯基
(2)取代反應
(3)(CH3)2C=CHCH2Br
(4)
(5)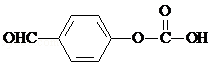 或
或 
(6)
【解析】解:(1)由A的結構簡式可知,其含有的官能團有酚羥基、酯基,故答案為:酚羥基、酯基;(2)反應③是取代反應,生成酯基和CH2CH2Br,故答案為:取代反應;(3)反應⑦是在苯環的另一個空位上引入(CH3)2C=CHCH2CH2﹣,還得到HBr,說明是G與(CH3)2C=CHCH2Br發生取代反應,
故答案為:(CH3)2C=CHCH2Br;(4)反應⑤是在苯環上引入﹣CH2Cl,因為苯環上有兩個空位,所以F可能存在同分異構體  ,
,
故答案為: 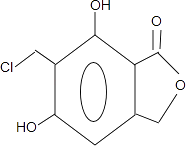 ;(5)E除苯環外還有4個氧原子2個碳原子,E的同分異構體可以發生銀鏡反應,說明含有醛基,能夠與NaHCO3反應產生CO2,說明含有羧基,是芳香族化合物,且核磁共振氫譜圖顯示分子中有4種不同化學環境的氫,說明羧基和醛基在對位,E的同分異構體為
;(5)E除苯環外還有4個氧原子2個碳原子,E的同分異構體可以發生銀鏡反應,說明含有醛基,能夠與NaHCO3反應產生CO2,說明含有羧基,是芳香族化合物,且核磁共振氫譜圖顯示分子中有4種不同化學環境的氫,說明羧基和醛基在對位,E的同分異構體為 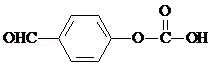 或
或  ,
,
故答案為: 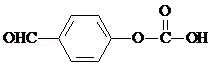 或
或  ;(6)以
;(6)以  、HCHO為原料制備
、HCHO為原料制備  ,需先在酚羥基的臨位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基與甲酸酯化生成
,需先在酚羥基的臨位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基與甲酸酯化生成  ,合成路線流程圖為:
,合成路線流程圖為: 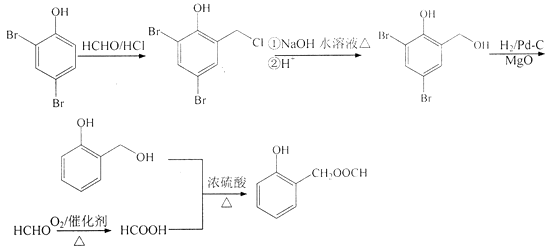
故答案為: 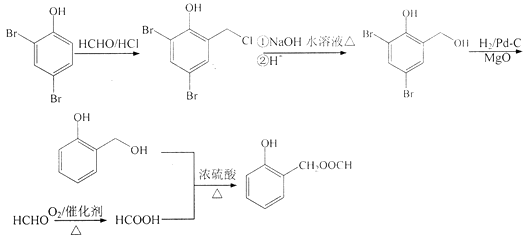 .
.
由合成H的路線圖可知,反應①是酚羥基臨位上的溴代反應,反應②是甲基上的鹵代反應,反應③是取代反應,生成酯基,反應④是去掉苯環上的溴原子,反應⑤是在苯環上引入﹣CH2Cl,因為苯環上有兩個空位,所以F可能存在同分異構體,反應⑥是使﹣CH2Cl生成﹣CH3的反應,反應⑦是在苯環的另一個空位上引入(CH3)2C=CHCH2﹣;以  、HCHO為原料制備
、HCHO為原料制備  ,需先在酚羥基的臨位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基與甲酸酯化生成
,需先在酚羥基的臨位引入﹣CH2Cl,在水解生成﹣OH,去掉Br,醛基與甲酸酯化生成  ,據此分析.
,據此分析.


 學而優暑期銜接南京大學出版社系列答案
學而優暑期銜接南京大學出版社系列答案 Happy holiday歡樂假期暑假作業廣東人民出版社系列答案
Happy holiday歡樂假期暑假作業廣東人民出版社系列答案科目:高中化學 來源: 題型:
【題目】“鋼是虎,釩是翼,鋼含釩猶如虎添翼”,釩是“現代工業的味精”。釩對稀酸是穩定的,但室溫下能溶解于濃硝酸中生成VO2+。
(1)請寫出金屬釩與濃硝酸反應的離子方程式:__________________________________,
(2)灼燒NH4VO3時可生成釩的氧化物V2O5,請寫出該反應的化學方程式:___________。
(3)V2O5是較強的氧化劑。它能與沸騰的濃鹽酸作用產生氯氣,其中釩元素被還原為藍色的VO2+,請寫出該反應的離子方程式:______________________________________。
(4)V2O5是兩性氧化物,與強堿反應生成釩酸鹽(陰離子為VO43-),溶于強酸生成含釩氧離子(VO2+)的鹽。請寫出V2O5分別與燒堿溶液和稀硫酸反應生成的鹽的化學式:______、______。
(5)工業上用接觸法制硫酸時要用到V2O5。在氧化SO2的過程中,450℃時發生V2O5與VO2之間的轉化:V2O5+SO2=2VO2+SO3、4VO2+O2=2V2O5,說明V2O5在接觸法制硫酸過程中所起的作用是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素W、X、Y和Z在周期表中的相對位置如表所示,這四種元素原子的最外層電子數之和為21。下列關系正確的是( )
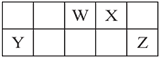
A. 氫化物沸點:W>Z B. 氧化物對應水化物的酸性:Y>W
C. WX2是酸性氧化物 D. 簡單離子的半徑: Y>X
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關,下列們關說法正確的是
A. 石墨具有良好的潤滑性,故可用做電池的電極材料。
B. 碳酸鈉溶液呈堿性,故可用帶玻璃塞的試劑瓶盛放
C. 液氮的沸點較低,故可為超導材料提供低溫環境
D. 單晶硅的硬度較高,故可用于制備電子芯片
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列有關稀溶液中離子濃度的說法正確的是( )
A.同濃度的四種溶液:①NH4Cl ②(NH4)2SO4③NH4HSO4④NH4Al(SO4)2溶液,c(NH4+)濃度的大小關系:②>④>③>①
B.一定濃度的NaHS溶液中:c(Na+)+c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
C.若0.1 mol/L NH4Cl溶液pH=5,則其中離子濃度最大與最小的差值為(0.1﹣10﹣5)mol/L
D.現有四種溶液:①pH=4的H2SO4溶液 ②pH=4的NH4Cl溶液 ③pH=10的氨水 ④pH=10的CH3COONa溶液,其中水電離出的氫離子濃度大小關系為:②=④>③>①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酸鈉(NaNO2)外觀酷似食鹽且有咸味,是一種常用的發色劑和防腐劑,使用過量會使人中毒。某興趣小組進行下面實驗探究,查閱資料知道:
①HNO2為弱酸 ;
②2NO+Na2O2=2NaNO2 ;
③2NO2+Na2O2=2NaNO3 ;
④酸性KMnO4溶液可將NO和NO2-均氧化為NO3-,MnO4-還原成Mn2+ 。NaNO2的制備方法可有如下2種方法(夾持裝置和加熱裝置已略,氣密性已檢驗):
(1)在制備裝置1中:
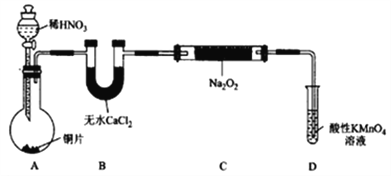
① 如果沒有B裝置,C中發生的副反應有_________,_________;
② 甲同學檢查完裝置氣密性良好后進行實驗,發現制得的NaNO2中混有較多的NaNO3雜質;于是在A裝置與B裝置間增加了 ____________裝置,改進后提高了NaNO2的純度;
③ D裝置發生反應的離子方程式為 ____________________。
(2)在制備裝置2中:
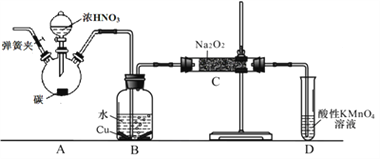
① B裝置的作用是 _________________________;
② 寫出裝置A燒瓶中發生反應的化學方程式并用單線橋標出電子的轉移 _____;
③ 為避免B中逸出的氣體中混有的雜質氣體與Na2O2反應,應在B、C裝置間增加一個裝置,則該裝置中盛放的藥品名稱為 ________;
④根據題中所給信息,設計實驗檢驗裝置C中NaNO2的存在時,應使用_________。(填試劑名稱)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素在周期表中的位置,反映了元素的原子結構和元素的性質,下列說法正確的是( )
A.短周期元素形成離子后,最外層都達到8電子穩定結構
B.第二周期元素的最高正化合價等于它所處的主族序數
C.同一元素可能既表現金屬性,又表現非金屬性
D.同一主族的元素的原子,最外層電子數相同,化學性質完全相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現在污水治理越來越引起人們重視,可以通過膜電池除去廢水中的乙酸鈉和對氯苯酚(![]() ),其原理如下圖所示,下列說法正確的是
),其原理如下圖所示,下列說法正確的是

A. 該裝置為電解裝置,B為陽極
B. 電子是從A極沿導線經小燈泡流向B極
C. A極的電極反應式為![]()
D. 當外電路中有0.1mole-轉移時,A極區增加的H+的個數為0.05NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com