
【題目】下列反應中,相關示意圖像錯誤的是:
A.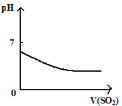 將二氧化硫通入到一定量氯水中
將二氧化硫通入到一定量氯水中
B.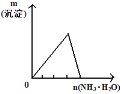 將氨水滴入到一定量氯化鋁溶液中
將氨水滴入到一定量氯化鋁溶液中
C.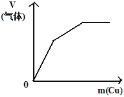 將銅粉加入到一定量濃硝酸中
將銅粉加入到一定量濃硝酸中
D.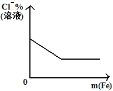 將鐵粉加入到一定量氯化鐵溶液中
將鐵粉加入到一定量氯化鐵溶液中
【答案】B
【解析】
A.當向氯水中通入二氧化硫時,氯水中的氯氣具有強氧化性,在水溶液中能把二氧化硫氧化成硫酸,氯氣和二氧化硫、水的反應方程式為 Cl2+SO2+2H2O=H2SO4+2HCl,所以溶液的酸性增強,pH值減小,最后達定值,故A正確;
B.氯化鋁和氨水反應生成氫氧化鋁沉淀,氫氧化鋁不和弱堿反應,所以將氨水滴入到一定量氯化鋁溶液中沉淀先逐漸增大最后達到最大值,沉淀不溶解,故B錯誤;
C.銅先和濃硝酸反應生成二氧化氮氣體,隨著反應的進行,濃硝酸變成稀硝酸,銅和稀硝酸反應生成一氧化氮,當硝酸完全反應時,生成的氣體為定值,故C正確;
D.鐵和氯化鐵反應生成氯化亞鐵,溶液中離子數目增多,氯離子的量不變,所以氯離子的百分含量減少,到三價鐵離子反應完全后,氯離子的百分含量不再變化,故D正確;
故答案為B。


科目:高中化學 來源: 題型:
【題目】如圖是某同學用含有鐵銹的廢鐵屑制取氯化鐵的裝置(省略夾持裝置,氣密性完好)。下列說法正確的是

A. 裝置A中存在反應:2Fe3++Fe=3Fe2+
B. 實驗開始時,打開活塞a,鹽酸快速流人裝置A中
C. 裝置B中收集到的氣體可直接點燃
D. 反應后的燒杯中通入少量SO2,溶液顏色立即由棕黃色變為淺綠色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖中,甲是電解飽和食鹽水,乙是銅的電解精煉,丙是電鍍,回答:

(1)b極上的電極反應式為__,甲電池的總反應化學方程式是__。
(2)在粗銅的電解過程中,圖中c電極的材料是__(填“粗銅板”或“純銅板”);在d電極上發生的電極反應為__;若粗銅中還含有Au、Ag、Fe等雜質,則沉積在電解槽底部(陽極泥)的雜質是__,電解一段時間后,電解液中的金屬離子有__。
(3)如果要在鐵制品上鍍鎳(二價金屬,相對原子質量59),則f電極的材料是__(填“鐵制品”或“鎳塊”,下同),e電極的材料是__。
(4)若e電極的質量變化118 g,則a電極上產生的氣體在標準狀況下的體積為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向一定濃度的Na2C2O4溶液中滴加鹽酸,混合溶液的pH與離子濃度變化關系如圖所示。已知H2C2O4是二元弱酸,X表示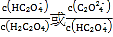 ,下列敘述錯誤的是
,下列敘述錯誤的是
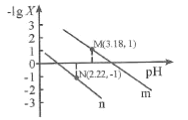
A.從M點到N點的過程中,c(H2C2O4)逐漸增大
B.直線n表示pH與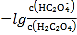 的關系
的關系
C.由N點可知Ka1 (H2C2O4)的數量級為10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水電離出氫離子濃度隨滴入氨水體積變化如圖。下列分析正確的是( )

A. NaHB溶液可能為酸性,也可能為堿性
B. A、B、C三點溶液的pH是逐漸減小,D、E、F三點溶液的pH是逐漸增大
C. E溶液中離子濃度大小關系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F點溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)用O2將HCl轉化為Cl2,可提高效益,減少污染.傳統上該轉化通過如圖所示的催化劑循環實現,其中,反應①為 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反應②生成1molCl2(g)的反應熱為
反應②生成1molCl2(g)的反應熱為![]() ,則總反應的熱化學方程式為_______________(反應熱△H用含
,則總反應的熱化學方程式為_______________(反應熱△H用含![]() 和
和![]() 的代數式表示)。
的代數式表示)。
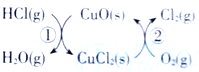
(2)在容積為1L的密閉容器中,通入一定量的N2O4,發生反應N2O4(g) 2NO2(g),隨溫度升高,混合氣體的顏色變深。回答下列問題:
①該反應的![]() ____________0(填“>”或“<”);100℃時,體系中各物質濃度隨時間變化如下表所示。在0~60s時段,反應速率υ(N2O4)為_________mol·L-1·s-1;40s時C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃時,體系中各物質濃度隨時間變化如下表所示。在0~60s時段,反應速率υ(N2O4)為_________mol·L-1·s-1;40s時C2___________0.10mol/L(填“>”或“<”)。
②100℃時達平衡后,改變反應溫度為![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,經10s又達到平衡。則T______100℃(填“>”或“<”)。
的平均速率降低,經10s又達到平衡。則T______100℃(填“>”或“<”)。
③計算溫度T時反應的平衡常數K___________。
(3)溫度T時反應達平衡后,將反應容器的容積減少一半。平衡向___________(填“正反應”或“逆反應”)方向移動,N2O4的轉化率______(填“增大”或“減小”)。
時間(s) | 0 | 20 | 40 | 60 | 80 |
N2O4濃度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2濃度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向2L密閉容器中充入2molSO2和一定量的O2,發生反應:2SO2(g)+O2(g)![]() 2 SO3(g),當反應進行到4min時,測知SO2為0.4mol,當反應進行到2min時,密閉容器中SO2物質的量為
2 SO3(g),當反應進行到4min時,測知SO2為0.4mol,當反應進行到2min時,密閉容器中SO2物質的量為
A.等于1.2molB.小于1.2molC.大于1.2molD.無法判斷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國鈦資源豐富,攀枝花和西昌已探明鈦礦儲量就有幾十億噸,其重要的礦石有金紅石![]() 、鈦鐵礦
、鈦鐵礦![]() 以及釩鈦鐵礦.如圖1所示,將鈦廠、氯堿廠和甲醇廠組成產業鏈可以大大提高資源利用率.
以及釩鈦鐵礦.如圖1所示,將鈦廠、氯堿廠和甲醇廠組成產業鏈可以大大提高資源利用率.
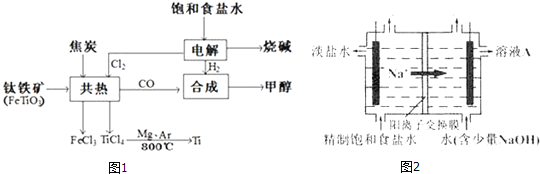
![]() 常溫下為無色液體,具有刺激性氣味,極易水解,其化學鍵類型為 ______ ,寫出
常溫下為無色液體,具有刺激性氣味,極易水解,其化學鍵類型為 ______ ,寫出![]() 水解的方程式 ______
水解的方程式 ______
![]() 寫出鈦鐵礦與焦炭、
寫出鈦鐵礦與焦炭、![]() 共熱得到
共熱得到![]() 的化學方程式: ______
的化學方程式: ______
![]() ①
① ![]()
②![]()
請寫出上圖中![]() 生成Ti的熱化學反應方程式: ______
生成Ti的熱化學反應方程式: ______
![]() 海綿鈦可用碘提純,原理為
海綿鈦可用碘提純,原理為![]()
![]() 下列說法正確的是 ______
下列說法正確的是 ______
A 該反應正反應的![]()
B 在不同溫度區域,![]() 的量保持不變
的量保持不變
C 在提純過程中,![]() 的作用是將粗鈦從低溫區轉移到高溫區
的作用是將粗鈦從低溫區轉移到高溫區
D 在提純過程中,![]() 可循環利用
可循環利用
![]() 鈦網做陽極電解飽和食鹽水常用隔膜電解槽.圖2為陽離子交換膜電解槽示意圖.
鈦網做陽極電解飽和食鹽水常用隔膜電解槽.圖2為陽離子交換膜電解槽示意圖.
①該電解裝置陽極在 ______ ![]() 填左室、右室
填左室、右室![]() 氯堿工業電解槽一般采用Ti網作陽極而不用Fe網,其原因是 ______ .
氯堿工業電解槽一般采用Ti網作陽極而不用Fe網,其原因是 ______ .
②右室中加入少量NaOH的原因是 ______ .
![]() 在上述產業鏈中合成112t甲醇理論上能生產Ti ______
在上述產業鏈中合成112t甲醇理論上能生產Ti ______ 不考慮生產過程中物質的任何損失
![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com