
| 催化劑 |
| 催化劑 |
| 催化劑 |
| 催化劑 |
| 催化劑 |
| 催化劑 |


科目:高中化學 來源: 題型:閱讀理解
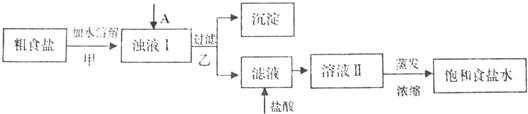
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:

| 濃硫酸 |
| △ |
| 濃硫酸 |
| △ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 反應進程(分鐘) | 1 | 2 | 5 | 15 | 20 |
| 4.0mol/L鹽酸 | 少量氣泡 | 較多氣泡 | 大量氣泡 | 反應劇烈 | 反應結束 |
| 2.0mol/L硫酸 | 無明顯現象 | 極少量氣泡 | 少量氣泡 | ||
| 4.0mol/L硫酸 | 無明顯現象 | 少量氣泡 | 有比較連續的氣泡 | ||
 請回答:
請回答:| 實驗目的 | 實驗 編號 |
溫度 | 金屬鋁 形態 |
鹽酸濃度 /mol?L-1 |
| (1)實驗①和②探究鹽酸濃度對該反應速率的影響; (2)實驗①和③探究溫度對該反應速率的影響; (3)實驗①和④探究金屬規格(鋁片、鋁粉)對該反應速率的影響. |
① | 25?C | 鋁片 | 4.0 |
| ② | 25?C 25?C |
鋁片 鋁片 |
2.0 2.0 | |
| ③ | 35℃ 35℃ |
鋁片 鋁片 |
4.0 4.0 | |
| ④ | 25?C 25?C |
鋁粉 鋁粉 |
4.0 4.0 |
| 1 |
| 2 |


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com