
【題目】(1)在400℃時,將一定量的SO2和14molO2壓入一個盛有催化劑的10L密閉容器中進行反應:2SO2+O2![]() 2SO3,已知2min后,容器中剩余2molSO2和12molO2,則:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,則:
①生成了__molSO3,SO2的起始物質的量濃度是__。
②2min內平均反應速率:v(O2)=__。
(2)某溫度時,在2 L的密閉容器中,X、Y、Z三種物質的量隨時間的變化曲線如圖所示。
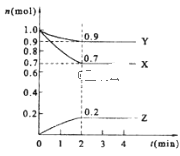
①X的轉化率是__;
②由圖中所給數據進行分析,該反應的化學方程式為___;
③若三種物質都是氣體,則平衡時Y所占體積的百分比為__。
【答案】4 0.6mol/L 0.1mol/(Lmin) 30% 3X+Y2Z 50%
【解析】
(1)①設開始時加入SO2的物質的量為x mol,根據已知信息可列出三段式計算生成SO3物質的量以及SO2的起始物質的量濃度;
②依據公式![]() 計算反應速率;
計算反應速率;
(2)①根據![]() 計算X的轉化率;
計算X的轉化率;
②根據物質的量的變化判斷X、Y為反應物,Z為生成物,再根據物質的量的變化之比等于化學計量數之比書寫方程式;
③根據物質的量分數等于體積分數計算Y所占體積的百分比。
(1)①設開始時加入SO2的物質的量為x mol,則可列出三段式,
2SO2+O2![]() 2SO3
2SO3
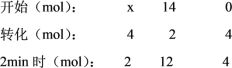
則 x-4=2,解得,x=6mol,則開始時加入SO2的物質的量為6 mol,SO2的起始物質的量濃度是![]() ,生成了4 molSO3;
,生成了4 molSO3;
故答案為:4;0.6mol/L;
②2min內平均反應速率:![]() ;
;
故答案為:0.1mol/(Lmin);
(2)①由圖象可知,從反應開始到平衡,X的物質的量從1mol變為0.7mol,則X轉化率為![]() ;
;
故答案為:30%;
②由圖象可以看出,反應中X、Y的物質的量減小,Z的物質的量增多,則X、Y為反應物,Z為生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,則反應的化學方程式為3X+Y2Z;
故答案為:3X+Y2Z;
③平衡時,X為0.7mol,Y為0.9mol,Z為0.2mol,若三種物質都是氣體,則平衡時Y所占體積的百分比為![]() ;
;
故答案為:50%。


科目:高中化學 來源: 題型:
【題目】298K時,合成氨反應的熱化學方程式為:
N2(g)+3H2(g)![]() 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
在該溫度下,取1molN2和3molH2放在一密閉容器中,在催化劑存在時進行反應,測得反應放出的熱量總是小于92.4 kJ是______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】疊氮酸(HN3)與醋酸的酸性相似,0.2 mol HN3與0.2 mol NaOH反應后將溶液稀釋至500 mL,測得溶液pH=a,下列說法一定錯誤的是( )
A.HN3水溶液中微粒濃度大小順序為c(HN3)>c(H+)>c(N3—)>c(OH-)
B.題示500 mL溶液中離子濃度大小順序為c(Na+)>c(N3—)>c(OH-)>c(H+)
C.題示500 mL溶液中由水電離產生的c(OH-)=1×10-amol·L-1
D.根據題給數據可以計算該溫度下疊氮酸的電離平衡常數Ka
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 在KI溶液中存在平衡:
在KI溶液中存在平衡:![]() ,某
,某![]() 、KI混合溶液中,
、KI混合溶液中,![]() 與溫度T的平衡曲線圖如圖。下列說法不正確的是( )
與溫度T的平衡曲線圖如圖。下列說法不正確的是( )

A.反應![]() 的
的![]()
B.若溫度為![]() 、
、![]() ,反應的平衡常數分別為
,反應的平衡常數分別為![]() 、
、![]() ,則
,則![]()
C.若反應進行到狀態D時,一定有![]()
D.狀態A與狀態B相比,狀態A的![]() 小
小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于氨氣的說法正確的是
A.氨既能用濃硫酸干燥也能用無水CaCl2干燥
B.NH3是電解質,所以氨水能導電
C.NH3可以使干燥的紅色石蕊試紙變藍
D.用水吸收NH3用如圖裝置可防止倒吸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置的相關描述不正確的是
A.![]() 可用于葉綠體中色素的分離
可用于葉綠體中色素的分離
B.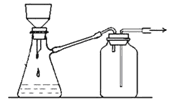 可用于過濾顆粒很小的沉淀,不宜于過濾膠狀沉淀
可用于過濾顆粒很小的沉淀,不宜于過濾膠狀沉淀
C. 可用于某些化學反應速率的測定。該裝置氣密性的檢查如下:儀器組裝好后,關閉分液漏斗活塞,將針筒活塞向外拉一段距離,然后松手,觀察針筒是否能回到原來刻度處
可用于某些化學反應速率的測定。該裝置氣密性的檢查如下:儀器組裝好后,關閉分液漏斗活塞,將針筒活塞向外拉一段距離,然后松手,觀察針筒是否能回到原來刻度處
D. 不可用來模擬氯堿工業
不可用來模擬氯堿工業
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA是阿伏加德羅常數的值,下列說法不正確的是
A.5.5g超重水(T2O)中含有的中子數目為3NA
B.常溫常壓下,44gCO2與足量過氧化鈉反應轉移電子的數目為NA
C.常溫常壓下,42gC2H4和C4H8混合氣體中含有氫原子的數目為6NA
D.0.1L0.5mol·L-1CH3COOH溶液中含有H+數目為0.2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(室溫下與水緩慢反應)是一種新型無機材料,廣泛應用于集成電路生產領域。化學研究小組同學按下列流程制取氮化鋁并測定所得產物中AlN的質量分數。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
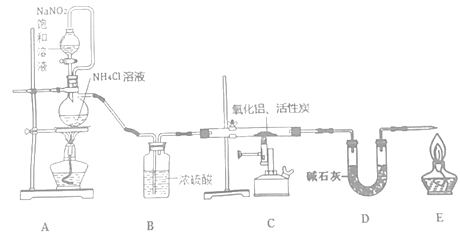
回答下列問題:
(1)檢查裝置氣密性,加入藥品,開始實驗。最先點燃___(“A”、“C”或“E”)處的酒精燈或酒精噴燈。
(2)裝置A中發生反應的離子方程式為___,裝置C中主要反應的化學方程式為___,制得的AlN中可能含有氧化鋁、活性炭外還可能含有___。
(3)實驗中發現氮氣的產生速率過快,嚴重影響尾氣的處理。實驗中應采取的措施是___(寫出一種措施即可)。
(4)稱取5.0g裝置C中所得產物,加入NaOH溶液,測得生成氨氣的體積為1.68 L(標準狀況),則所得產物中AlN的質量分數為___。
(5)也可用鋁粉與氮氣在1000℃時反應制取AlN。在鋁粉中添加少量NH4Cl固體并充分混合,有利于AlN的制備,共主要原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4和H2O(g)在催化劑表面發生反應CH4(g)+H2O(g) ![]() CO(g)+3H2(g),該反應僅在高溫下能自發進行。
CO(g)+3H2(g),該反應僅在高溫下能自發進行。
(1)該反應的 ΔH ____0(填“<” “>” 或 “=”)。
(2)T ℃時,向2L密閉容器中投入2mol CH4和1.5mol H2O(g),發生上述反應,平衡時CH4的轉化率為50%,該溫度下反應的平衡常數K=_____。
(3) T ℃時,向1 L密閉容器中投入2 mol CH4、1 mol H2O(g)、3 mol CO、2 mol H2,則反應的v(正)___v(逆) (選填“<” “>”或“=”)
(4)現向三個體積均為2L的恒容密閉容器I、II、Ⅲ中,均分別充入1molCO 和2mo1H2發生反應:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ/mol。三個容器的反應溫度分別為Tl、T2、T3且恒定不變。當反應均進行到5min時H2的體積分數如圖所示,其中只有一個容器中的反應已經達到平衡狀態。
CH3OH(g) ΔH1=-90.1kJ/mol。三個容器的反應溫度分別為Tl、T2、T3且恒定不變。當反應均進行到5min時H2的體積分數如圖所示,其中只有一個容器中的反應已經達到平衡狀態。

①5min時三個容器中的反應達到化學平衡狀態的是容器_______(填序號)。
②0-5 min內容器I中用CH3OH表示的化學反應速率v(CH3OH)=_______。(保留兩位有效數字)
③當三個容器中的反應均達到平衡狀態時,CO轉化率最高的是容器______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com