
某小組同學欲研究SO2的性質。
(1)將相關的含硫物質分為如下表所示3組,第2組中物質X的化學式是 。

(2)利用下圖所示的裝置研究SO2的性質:
(熔點:SO2 -76.1℃,SO3 16.8℃;沸點:SO2 -10℃,SO3 45℃)
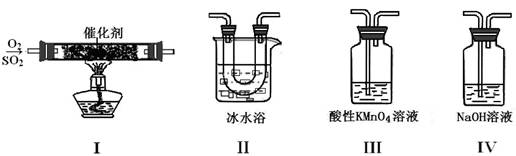
①裝置I模擬工業生產中SO2催化氧化的反應,其化學方程式是 。
②甲同學按I、II、III、IV的順序連接裝置,裝置II的作用是 ;裝置III中溶液逐漸褪色,生成Mn2+,同時pH降低,則該反應的離子方程式是 。
③乙同學按I、II、IV的順序連接裝置,若裝置IV中有40 mL 2.5 mol??L-1 NaOH溶液,反應后增重4.8 g,則裝置IV中發生反應的化學方程式是 。
(1)H2SO3
(2) ①2SO2 + O2 ![]() 2SO3
2SO3
②使SO3凝結成固體與SO2分離
5SO2 + 2H2O + 2MnO4- ![]() 5SO42- + 2Mn2+ + 4H+
5SO42- + 2Mn2+ + 4H+
③3SO2 + 4NaOH ![]() Na2SO3 + 2NaHSO3 + H2O
Na2SO3 + 2NaHSO3 + H2O
乙同學按I、II、IV的順序連接裝置,若裝置IV中有40 mL 2.5 mol??L-1 NaOH溶液,反應后增重4.8 g,消耗的NaOH物質的量為0.04L ![]() 2.5 mol??L-1=0.1mol,消耗的SO2為4.8/64=0.075mol,
2.5 mol??L-1=0.1mol,消耗的SO2為4.8/64=0.075mol,![]() SO2/
SO2/![]() NaOH=3/4,所以化學方程式為3SO2 + 4NaOH
NaOH=3/4,所以化學方程式為3SO2 + 4NaOH ![]() Na2SO3 + 2NaHSO3 + H2O
Na2SO3 + 2NaHSO3 + H2O


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2013-2014學年湖南省長沙市高三第三次月考化學試卷(解析版) 題型:填空題
(1)某化學興趣小組的同學進行Cl2、NH3的制備及性質檢驗等實驗的流程和部分裝置如下:
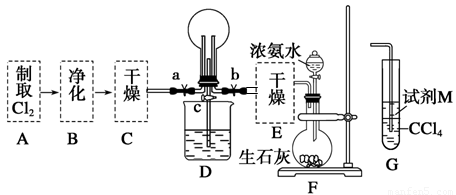
請利用A、G裝置設計一個簡單的實驗驗證Cl2、Fe3+、I2的氧化性強弱為Cl2>Fe3+>I2(實驗中不斷地小心振蕩G裝置中的試管)。A中反應物是KMnO4和濃鹽酸,請寫出A中發生反應的化學方程式: ,請寫出試劑M為 溶液,證明氧化性為Cl2>Fe3+>I2的實驗現象是 。
②已知3Cl2+2NH3=6HCl+N2,當D的燒瓶中充滿黃綠色氣體后,關閉a、c打開b,D中的現象為黃綠色氣體消失,產生白煙,反應一段時間后,關閉b打開c,觀察到的現象為_________________________________________________________________。
(2)某廢水中含有一定量的Na+、SO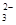 ,可能含有CO
,可能含有CO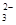 ,某研究小組欲測定其中SO
,某研究小組欲測定其中SO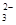 的濃度,設計如下實驗方案:
的濃度,設計如下實驗方案:

①從下列試劑中選擇試劑X為_________(填序號);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入試劑X生成SO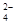 的離子方程式為_____________________________________;
的離子方程式為_____________________________________;
③證明該廢水中是否含有CO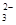 的實驗方案為
。
的實驗方案為
。
查看答案和解析>>
科目:高中化學 來源:2013-2014學年湖南省長沙市高三第三次月考化學試卷(解析版) 題型:填空題
(1)某化學興趣小組的同學進行Cl2、NH3的制備及性質檢驗等實驗的流程和部分裝置如下:
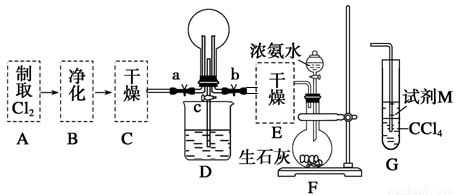
請利用A、G裝置設計一個簡單的實驗驗證Cl2、Fe3+、I2的氧化性強弱為Cl2>Fe3+>I2(實驗中不斷地小心振蕩G裝置中的試管)。A中反應物是KMnO4和濃鹽酸,請寫出A中發生反應的化學方程式: ,請寫出試劑M為 溶液,證明氧化性為Cl2>Fe3+>I2的實驗現象是 。
②已知3Cl2+2NH3=6HCl+N2,當D的燒瓶中充滿黃綠色氣體后,關閉a、c打開b,D中的現象為黃綠色氣體消失,產生白煙,反應一段時間后,關閉b打開c,觀察到的現象為_________________________________________________________________。
(2)某廢水中含有一定量的Na+、SO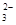 ,可能含有CO
,可能含有CO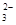 ,某研究小組欲測定其中SO
,某研究小組欲測定其中SO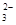 的濃度,設計如下實驗方案:
的濃度,設計如下實驗方案:

①從下列試劑中選擇試劑X為_________(填序號);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入試劑X生成SO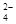 的離子方程式為_____________________________________;
的離子方程式為_____________________________________;
③證明該廢水中是否含有CO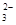 的實驗方案為
。
的實驗方案為
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com