
【題目】Ⅰ、秋冬季節是流感發作的高峰期,“84消毒液”能有效殺滅流感病毒。巴蜀中學某同學購買的“84消毒液”瓶體部分標簽如圖所示,通常稀釋100倍(體積比)后使用。請回答下列問題:

(1)該“84消毒液”的物質的量濃度約為______mol/L。
(2)該同學參閱“84消毒液”的配方,欲用NaClO固體配制250mL上述濃度的消毒液:
①需要用托盤天平稱量NaClO固體的質量為_______g。
②實驗中所用的玻璃儀器除燒杯、玻璃棒、量筒外,還有_____________。
(3)實驗過程中下列操作或說法不正確的是_____。
A、容量瓶用蒸餾水洗凈之后,應烘干后才能用于溶液的配制
B、配制過程中,未用蒸餾水洗滌燒杯和玻璃棒會導致所得溶液濃度偏低
C、定容時,俯視刻度線會導致所得溶液濃度偏低
D、搖勻后,發現液面低于刻度線,又滴加蒸餾水至與刻度線相切
(4)經過查閱資料,測定所配消毒液中NaClO的物質的量濃度的方法如下:準確取出10.00mL消毒液稀釋至1000.00mL,量取稀釋液20.00mL于錐形瓶中,加入過量的NaI溶液,用足量的醋酸酸化,充分反應后向溶液中滴加0.0500 mol/L Na2S2O3溶液,完全反應時消耗Na2S2O3溶液30.40mL。反應過程中的相關化學方程式為: ![]()
![]() ,通過計算求出所配消毒液中NaClO的物質的量濃度為___________mol/L 。(保留兩位有效數字)
,通過計算求出所配消毒液中NaClO的物質的量濃度為___________mol/L 。(保留兩位有效數字)
Ⅱ、某工廠的工業廢水中含有大量FeSO4,較多的CuSO4和少量的Na2SO4,為了減少污染并變廢為寶,工廠計劃從該廢水中回收硫酸亞鐵和銅。請根據下列流程,完成實驗方案(可供選擇的試劑為鐵粉、稀H2SO4、NaOH溶液)
(1)操作a的名稱為____,所需的玻璃儀器有_____。
(2)固體E的成分為____(填化學式),加入的試劑④為_________。
(3)加入試劑①的目的是__________。
(4)從溶液D和溶液G中得到FeSO4.7H2O晶體的操作為_______,過濾,洗滌,干燥。
【答案】4.0 74.5 250mL容量瓶、膠頭滴管 ACD 3.8 過濾 漏斗、玻璃棒、燒杯 Fe和Cu 稀硫酸 將溶液中的Fe2+和Cu2+轉化為沉淀,便于與含有Na+的溶液分離 蒸發濃縮,冷卻結晶
【解析】
I.根據質量分數計算物質的量濃度;根據溶液配制原理分析實驗所需儀器,并進行誤差分析;
II.先加過量堿,過濾得到Cu(OH)2,Fe(OH)2沉淀,濾液是Na2SO4、NaOH溶液,在Cu(OH)2,Fe(OH)2中加過量稀H2SO4,溶液C的成分為CuSO4,FeSO4、H2SO4;在溶液中加過量鐵,過濾出Fe、Cu,濾液D是FeSO4,在固體E中加過量稀H2SO4,過濾出Cu,實現了回收金屬銅,濾液是FeSO4、H2SO4,最后溶液合一塊,進行蒸發,濃縮,冷卻結晶,過濾,就得到FeSO47H2O,回收硫酸亞鐵,以此解答該題。
I.(1)c(NaClO)=![]() ,故答案為:4.0;
,故答案為:4.0;
(2)①m(NaClO)=0.25L×4mol/L×74.5g/mol=74.5g;②配制過程中還需要250mL容量瓶和膠頭滴管,故答案為:74.5;250mL容量瓶、膠頭滴管;
(3)A、容量瓶用蒸餾水洗凈之后,不需要烘干,可以直接進行配制溶液,故A錯誤;
B、配制過程中,未用蒸餾水洗滌燒杯和玻璃棒,損失了溶質,會導致所得溶液濃度偏低,故B正確;
C、定容時,俯視刻度線會使溶液體積偏小,則會導致所得溶液濃度偏大,故C錯誤;
D、搖勻后,發現液面低于刻度線,又滴加蒸餾水至與刻度線相切會使溶液濃度偏低,故D錯誤;故答案為:ACD;
(4)NaClO~I2~2Na2S2O3,n(NaClO)=1/2n(Na2S2O3)=1/2×0.0500 mol/L×30.40mL×10-3=0.00076mol,則c(NaClO)=![]() =3.8mol/L,故答案為:3.8mol/L。
=3.8mol/L,故答案為:3.8mol/L。
II.(1)操作a為過濾,用于分離固體和液體,用到的玻璃儀器有漏斗、玻璃棒、燒杯,故答案為:過濾;漏斗、玻璃棒、燒杯;
(2)固體E為Fe和Cu,可加入硫酸,故答案為:Fe和Cu;稀硫酸;
(3)試劑①應為氫氧化鈉,可將溶液中的Fe2+和Cu2+轉化為沉淀,便于與含有Na+的溶液分離,故答案為:將溶液中的Fe2+和Cu2+轉化為沉淀,便于與含有Na+的溶液分離;
(4)從溶液D和溶液G中得到FeSO4.7H2O晶體的操作為蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,故答案為:蒸發濃縮,冷卻結晶。


科目:高中化學 來源: 題型:
【題目】常溫下,0.1 mol·L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列敘述中正確的是( )
A. 0.01 mol·L-1HA的溶液中c(H+)=1×10-4mol·L-1
B. pH=3的HA溶液與pH=11的NaOH溶液等體積混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
C. 濃度均為0.1 mol·L-1的HA溶液和NaA溶液等體積混合后所得溶液顯酸性,則c(OH-)-c(H+)<c(HA)-c(A-)
D. pH=3的HA溶液與pH=11的NaOH溶液按體積比1:10混合后所得溶液中c(OH-)+c(A-)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】150℃時,11.6g CO2和H2O的混合氣體與足量的Na2O2充分反應后,固體物質的質量增加了3.6g,則原混合氣體中CO2與H2O的物質的量之比是( )
A.1:4B.3:11C.1:11D.21:22
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等物質的量的X(g)與Y(g)在密閉容器中進行可逆反應:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列敘述正確的是 ( )
2Z(g)+W(s) ΔH<0,下列敘述正確的是 ( )
A. 平衡常數K值越大,X的轉化率越大
B. 達到平衡時,反應速率v正(X)=2v逆(Z)
C. 達到平衡后降低溫度,正向反應速率減小的倍數大于逆向反應速率減小的倍數
D. 達到平衡后,升高溫度或增大壓強都有利于該反應平衡向逆反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某新型可充電電池構造如圖所示,工作時(需先引發Fe 和KClO3的反應,從而使 LiCl-KCl共晶鹽熔化),某電極(記為X )的反應式之一為:xLi++ xe- +LiV3O8=Lii+xV3O8。下列說法正確的是

A.放電時,正極的電極反應式為: Li – e- = Li+
B.放電時,總反應式為:xLi + LiV3O8 = Lii+xV3O8
C.充電時,X電極與外接電源負極相連
D.充電時,X電極的質量增加
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2 L容器中三種物質的物質的量隨時間的變化曲線如圖所示。由圖中數據分析,該反應的化學方程式和反應開始至2 min末Z的平均反應速率分別為( )

A. X+3Y![]() 2Z 0.1 mol/(L·min) B. 2X+Y
2Z 0.1 mol/(L·min) B. 2X+Y![]() 2Z 0.1 mol/(L·min)
2Z 0.1 mol/(L·min)
C. X+2Y![]() Z 0.05 mol/(L·min) D. 3X+Y
Z 0.05 mol/(L·min) D. 3X+Y![]() 2Z 0.05 mol/(L·min)
2Z 0.05 mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗小組探究鹽酸和NaOH反應過程中溶液pH的變化規律,得到如圖所示曲線。下列有關該實驗事實的說法正確的是( )

A.A點時溶液呈酸性
B.B點表示鹽酸和NaOH恰好完全反應
C.C點時,溶液中的溶質只有氯化鈉
D.該實驗是將NaOH溶液滴入鹽酸中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】臭氧是理想的煙氣脫硝試劑,其脫硝反應為:![]() ,該反應一定條件下可自發進行。若反應在恒容密閉容器中進行,下列由該反應作出的判斷(有關圖像)錯誤的是( )
,該反應一定條件下可自發進行。若反應在恒容密閉容器中進行,下列由該反應作出的判斷(有關圖像)錯誤的是( )
A.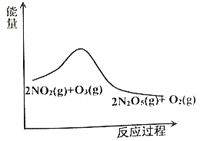 B.
B.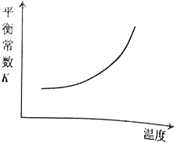
C.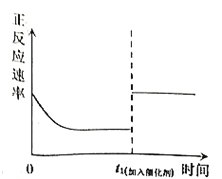 D.
D.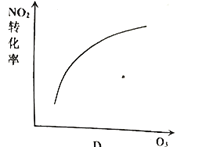
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在標準狀況下,1.7g氨氣所占的體積為_______L,它與標準狀況下______L硫化氫含有相同數目的氫原子。
(2)某氣態氧化物的化學式為RO2,在標準狀況下,1.28g該氧化物的體積為448mL,則該氧化物的摩爾質量為_______,R的相對原子質量為_________。
(3)已知CO、CO2的混合氣體質量共16.0g,標準狀況下體積為8.96L,則可推知該混合氣體中含CO___g,所含CO2在標準狀況下的體積為_______L。
(4)同溫同壓下,SO2與Cl2的密度之比為______;若質量相同,兩種氣體的體積比為_________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com