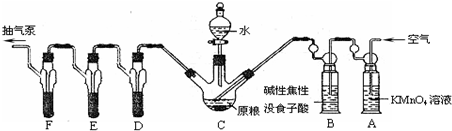
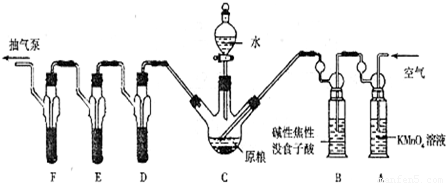
磷化鋁、磷化鋅、磷化鈣是我國目前最常見的熏蒸殺蟲劑的主要成分,它們都能與水或酸反應產生有毒氣體PH
3,PH
3具有較強的還原性,能在空氣中自燃.我國糧食衛生標準規定,糧食中磷化物(以PH
3計)含量≤0.05mg?kg
-1.現用如下裝置測定糧食中殘留磷化物含量.
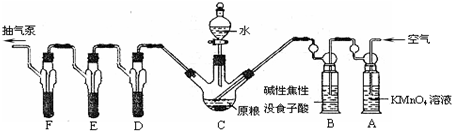
(已知:5PH
3+8KMnO
4+12H
2SO
4=5H
3PO
4+8MnSO
4+4K
2SO
4+12H
2O)C中盛有200g原糧;D、E、F各盛裝1.00mL濃度為1.00×10
-3 mol?L
-1的KMnO
4的溶液(H
2SO
4酸化).
(1)檢查上述裝置氣密性的方法是
打開抽氣泵抽氣,觀察各裝置中是否有氣泡產生
打開抽氣泵抽氣,觀察各裝置中是否有氣泡產生
.
(2)實驗過程中,用抽氣泵抽氣的目的是
保證生成的PH3進入D、E、F,被酸性KMnO4溶液全部吸收
保證生成的PH3進入D、E、F,被酸性KMnO4溶液全部吸收
.
(3)A中盛裝KMnO
4溶液是為除去空氣中可能含有的
還原性氣體
還原性氣體
;B中盛裝堿性焦性沒食子酸溶液的作用是
除去空氣中的O2
除去空氣中的O2
;如去除B裝置,則實驗中測得的PH
3含量將
偏低
偏低
.
(4)收集D、E、F所得吸收液,并洗滌D、E、F,將吸收液、洗滌液一并置于錐形瓶中,加水稀釋至25mL,用濃度為5×10
-4 mol?L
-1 Na
2SO
3標準溶液滴定剩余的KMnO
4溶液,消耗Na
2SO
3標準溶液11.00mL,則該原糧中磷化物(以PH
3計)的含量為
0.085g/kg
0.085g/kg
mg/kg.(已知:5Na
2SO
3+2KMnO
4+3H
2SO
4=K
2SO
4+5Na
2SO
4+2MnSO
4+3H
2O)




 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案