
| A. | 通入CO后,正反應速率逐漸增大 | |
| B. | 升高溫度,H2S濃度增加,表明該反應是放熱反應 | |
| C. | 反應前H2S物質的量為7mol | |
| D. | CO的平衡轉化率為20% |
分析 A.通入CO后,正反應速率瞬間增大,又逐漸減小;
B.升高溫度,H2S濃度增加,說明平衡逆向移動,升高溫度,平衡向吸熱反應方向移動;
C.反應前CO的物質的量為10mol,平衡后CO物質的量為8mol,設反應前H2S物質的量為n,則:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
變化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
反應恰好氣體分子數目不變,利用物質的量代替濃度代入平衡常數表達式計算;
D.根據C中的計算數據計算CO的平衡轉化率.
解答 解:A.通入CO后,正反應速率瞬間增大,又逐漸減小,故A錯誤;
B.升高溫度,H2S濃度增加,說明平衡逆向移動,升高溫度,平衡向吸熱反應方向移動,則該反應是放熱反應,故B正確;
C.反應前CO的物質的量為10mol,平衡后CO物質的量為8mol,設反應前H2S物質的量為n,則:
CO(g)+H2S(g)?COS(g)+H2(g)
起始(mol):10 n 0 0
變化(mol):2 2 2 2
平衡(mol):8 n-2 2 2
反應恰好氣體分子數目不變,可以利用物質的量代替濃度計算平衡常數,則平衡常數K=$\frac{2×2}{8×(n-2)}$=0.1,解得:n=7,故C正確;
D.根據上述數據,可知CO的平衡轉化率為:$\frac{2mol}{10mol}$×100%=20%,故D正確;
故選A.
點評 本題考查化學平衡的計算,題目難度中等,涉及影響化學反應速率的因素、化學平衡常數應用、化學平衡的有關計算,注意理解掌握三段式均解題法在化學平衡計算中的應用,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:解答題
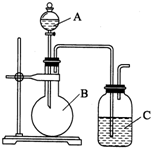 某同學設計如圖裝置,探究非金屬性質變化規律.
某同學設計如圖裝置,探究非金屬性質變化規律.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
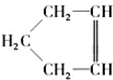 ,可簡寫為
,可簡寫為 ,降冰片烯的分子結構可表示為
,降冰片烯的分子結構可表示為 .
. .(任選一種)
.(任選一種)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大C的量,H2O的轉化率增大 | |
| B. | 減小容器體積,正、逆反應速率均減小 | |
| C. | 加入催化劑,平衡常數不變 | |
| D. | 升高溫度,平衡向逆反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由C(s,石墨)═C(s,金鋼石)△H>0可知,金剛石比石墨穩定 | |
| B. | CO(g)燃燒熱是283.0 kJ•mol-1,則2CO2(g)═2CO(g)+O2(g)△H=+566.0kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,該反應的化學能可以轉化為電能 | |
| D. | 已知C(s)+O2(g)═CO2(g)△H1,C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,則)△H1<△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
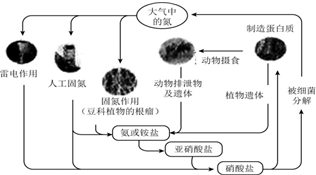
| A. | 上述氮循環中氮元素均被氧化 | |
| B. | 打雷閃電時涉及的一個反應為N2+2O2═2NO2 | |
| C. | 含氮無機物和含氮有機物可相互轉化 | |
| D. | 自然界氮循環中氮元素的質量增加了 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 A、B、C、D、E五種物質中均含有同一種非金屬元素,它們能發生如圖所示的轉化關系,該元素(用R)表示)的單質能與NaOH溶液反應生成鹽(Na2RO3)和氫氣.
A、B、C、D、E五種物質中均含有同一種非金屬元素,它們能發生如圖所示的轉化關系,該元素(用R)表示)的單質能與NaOH溶液反應生成鹽(Na2RO3)和氫氣.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com